11-1 фип,Малый Валентин Владимирович, 2 модуль, 23 вариант. Контрольное задание Модуль 2 Теория растворов
 Скачать 95.6 Kb. Скачать 95.6 Kb.
|
|
Малый Валентин Владимирович 11-1ФИП Вариант 23 Физическая и коллоидная химия Специальность- Фармация Контрольное задание Модуль №2 Теория растворов. 2020-2021 уч.год Что такое плазмолиз, лизис, гемолиз? Ли́зис — растворение клеток и их систем, в том числе микроорганизмов, под влиянием различных агентов, например ферментов. Плазмолиз - отделение протопласта от оболочки при погружении клетки в гипертонический раствор. Гемо́лиз — разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. Активность и коэффициент активности. Закон разведения Оствальда. Несмотря на то, что термодинамика не учитывает процессы, происходящие в реальных растворах, например, притяжение и отталкивание ионов, термодинамические закономерности, выведенные для идеальных растворов, можно применить и для реальных растворов, если заменить концентрации активностями. Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора. Активность может быть как меньше, так и больше номинальной концентрации вещества в растворе. Активность чистого растворителя, а также растворителя в не слишком концентрированных растворах принимается равной 1. За 1 принимается также активность твёрдого вещества, находящегося в осадке, или жидкости, не смешивающейся с данным раствором. В бесконечно разбавленном растворе активность растворённого вещества совпадает с его концентрацией. Отношение активности вещества в данном растворе к его концентрации называется коэффициентом активности. Коэффициент активности - это своеобразный поправочный коэффициент, показывающий, насколько реальность отличается от идеала. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства: где α — степень диссоциации. Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации. Влияние разбавления, добавления щелочей и кислот на рН буферного раствора. 1.Разбавление. При разбавлении водой концентрации кислоты и соли уменьшаются в одно и то же число раз, но соотношение lg С(соли)/С(кислоты) не меняется, поэтому рН буферного раствора практически не изменяется. Кроме того, рКкислоты или рКоснования не зависит от разбавления. 2.Добавление кислот и оснований. При добавлении в ацетатный буфер небольшого количества сильной кислоты ионы Н+ (образующиеся при ее диссоциации) связываются с ацетат-ионами, содержащимися в избытке, с образованием слабодиссоциирующих молекул СН3СООН. Степень диссоциации СН3СООН мала и концентрация [Н+] практически не меняется, рН буферного раствора уменьшится, но незначительно. 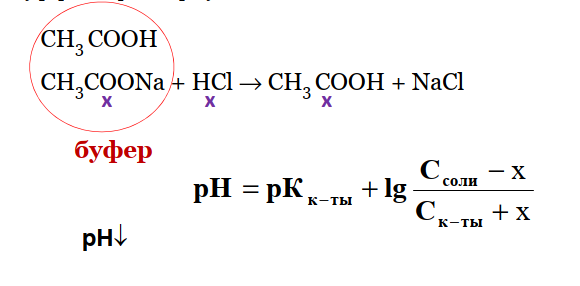 При добавлении небольшого количества NaOH, OH- ионы нейтрализуются кислотным компонентом буферного раствора, с образованием молекул воды. 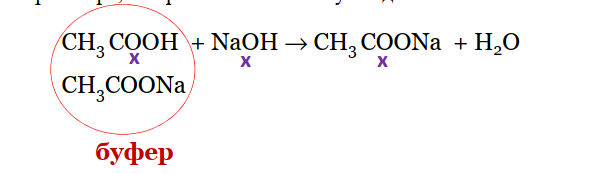 В результате добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания СН3СОО-, которое в меньшей степени влияет на реакцию среды. рН буферного раствора увеличивается, но незначительно. Задача: Сколько граммов глюкозы нужно растворить в 270 г воды для а) снижения температуры замерзания на I градус? б) для повышения температуры кипения на 1 градус?
Задача: Чему равен рН буферного раствора, в 10 л которого содержится 0,1 моль СН3СООН и 0,5 моль СН3СООК, если рК (СН3СООН) = 4,75 (здесь и в последующих расчетных тестах считать коэффициенты активности ионов в растворе равными единице, а температуру равной 298К)
ЗАДАЧА 69 Из 3-х веществ (столбцы 1-3) Вашего варианта выберите сильные и слабые электролиты и составьте уравнение диссоциации их в водном растворе. В столбце 1а приведены молярные концентрации раствора электролита из столбца 1. Исходя из данной молярной концентрации, определить молярную концентрацию эквивалента, титр и массовую долю вещества, принимая плотность раствора равной единице. Рассчитайте pH растворов электролитов, данных в столбцах 1 и 2 для концентраций в столбцах 1а и 2а, соответственно. Для раствора сильного электролита определите ионную силу раствора и активность катионов и анионов в этом растворе. Для раствора слабого электролита рассчитайте степень диссоциации по приближенной и строгой формуле Оствальда и сделайте вывод по полученным значениям. Рассчитайте концентрацию раствора соли (ст.3), если его рН равен – (ст.4).
| |||||||||||||||||||||||||||||||||||||||
