химия1. Ковалентная неполярная химическая связь
 Скачать 255.19 Kb. Скачать 255.19 Kb.
|
|
Урок № 12 Тема: Ковалентная неполярная химическая связь Тип урока: комбинированный Цель урока: сформировать представление о свойстве неметаллических элементов – электроотрицательности (ЭО) и ее изменении в периодах и группах (главных подгруппах) ПСХЭ Д.И. Менделеева; познакомить с рядом ЭО и научить им пользоваться; сформировать знания о механизме образования ковалентной неполярной химической связи между неметаллическими элементами с одинаковой ЭО, ее кратности и длине; научить характеризовать неметаллические элементы по их ЭО и образованию ковалентной неполярной связи, определять соединение с ковалентной неполярной связью и объяснять механизм ее образования. Ход урока Организационный момент Актуализация знаний Что такое ионная связь? Объясните механизм образования соединений с ионной связью. (На примере решения домашнего задания 2 стр. 66) Изучение нового материала Вспомним особенности строения неметаллических элементов. Все они на внешнем энергетическом уровне имеют больше четырех электронов, вследствие чего усиливается электростатическое притяжение их с положительно заряженным ядром атома. Атомный радиус неМе меньше атомного радиуса Ме, что обеспечивает их сильное с положительно заряженным ядром атома. Что же тогда происходит? Электроны объединяются в общую электронную пару за счет перекрывания их электронных орбиталей. Степень сближения атомов неМе при образовании общей электронной пары зависит от важного свойства элементов – их электроотрицательности (ЭО). Что такое ЭО? ЭО элемента характеризует способность его атома в молекуле притягивать к себе общую электронную пару. ЭО химических элементов в каждом периоде возрастает с увеличением порядкового номера элемента, а в каждой подгруппе уменьшается. Самым электроотрицательным элементом в ПСХЭ является фтор. Значения ЭО химических элементов сведены в таблицу электроотрицательности по Полингу.  С 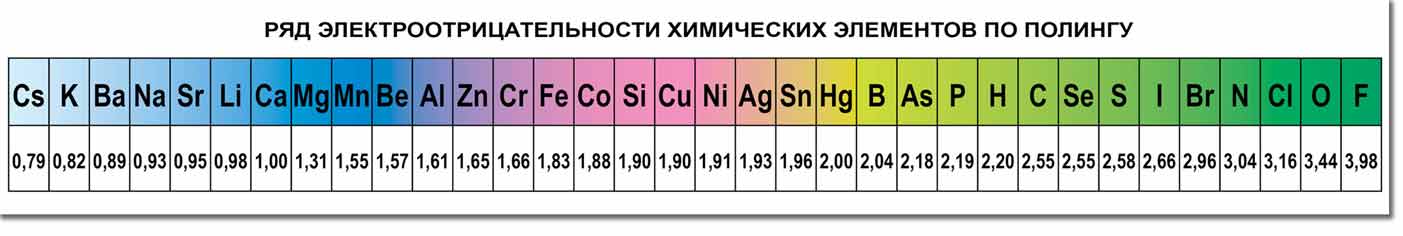 уществует также ряд элетроотрицательности химических элементов. уществует также ряд элетроотрицательности химических элементов.Рассмотрим механизм образования химической связи и ее вид в соединениях, образованных атомами неМе, которые обладают одинаковой ЭО. Возникает химическая связь за счет объединения электронов атомов неМе с одинаковой ЭО в общую электронную пару. Такая химическая связь называется ковалентной неполярной. Таким образом, если ковалентная связь образуется между атомами с одинаковой ЭО, то общая электронная пара (область перекрывания электронных облаков) находится на одинаковом расстоянии от ядер обоих атомов и такая связь называется ковалентной неполярной. Схема образования ковалентной неполярной связи на примере молекулы водорода (Н2) Схема строения атома водорода: Н+1 ) 1 Электронная формула: 1s1. На внешнем энергетическом уровне находится один непарный (неспаренный) электрон Н, это энергетически невыгодное состояние атома. 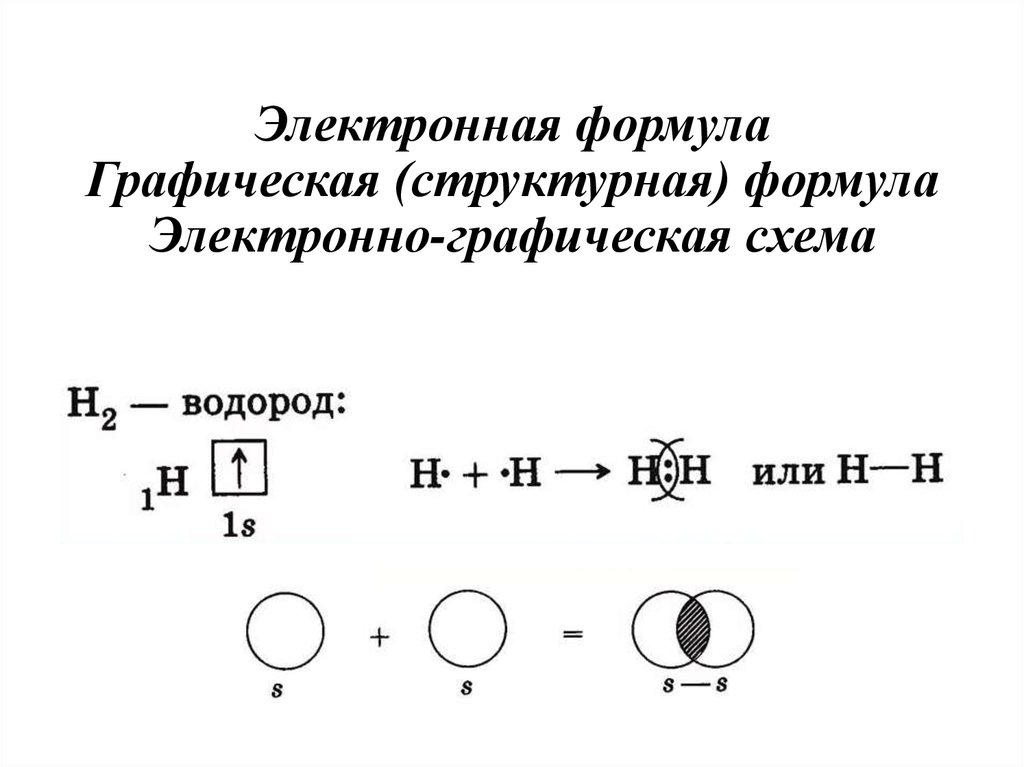 При сближении двух атомов водорода, у которых на внешнем энергетическом уровне по одному неспаренному электрону, образующему s-орбиталь, происходит перекрывание электронных орбиталей с образованием общей области повышенного отрицательного заряда. В этой области наиболее вероятно нахождение двух общих электронов. Положительно заряженные ядра атомов притягиваются к ней, в результате действия электрических сил возникает химическая связь и образуется молекула водорода.  У каждого атома водорода на внешнем энергетическом уровне находится по одному неспаренному электрону на s-орбиталях, происходит перекрывание их орбиталей с образованием общей электронной пары. У каждого атома водорода тем самым образуется завершенный внешний энергетический уровень. Структурная формула молекулы водорода: Н – Н. Связь одинарная. Аналогичным образом можно рассмотреть строение молекулы фтора F2. 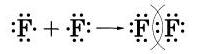 Структурная формула молекулы фтора: F – F. Связь одинарная. Часто возникает сложность с определением кол-ва неспаренных электронов. Воспользуемся формулой: 8 – N = число неспаренных электронов, где N – номер группы химического элемента. Ковалентная связь характеризуется не только кратностью, но и длиной, которая измеряется в нанометрах (1 нм = 10-9 м) В молекулах фтора связь одинарная, и длина между ядрами атомов составляет 0,14 нм. В молекуле азота связь тройная, ее длина составляет 0,11 нм. Рассмотрим механизм образования молекулы азота (N2): N+7 ) ) 2 5 Чтобы рассчитать число неспаренных электронов воспользуемся формулой: 8 – N = число неспаренных электронов, т.е. 8 – 5 = 3, тогда: 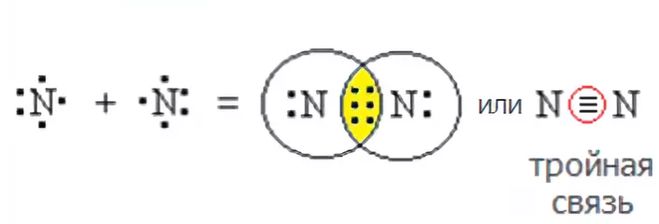  Важнейшие двухатомные молекулы: Н2, О2, N2, F2, Cl2, Br2, I2. Домашнее задание: § 11 + записи в тетради, упр. 1 – 5 стр. 70. |
