Кремний и его соединения
 Скачать 66 Kb. Скачать 66 Kb.
|
|
Тема: Кремний и его соединения.
Средства обучения: периодическая система химических элементов Д. И. Менделеева, схемы, коллекции, «Природные силикаты», «Стекло и изделия из стекла», дополнительная литература, лабораторное оборудование, презентация к уроку, химические реактивы: раствор соляной кислоты, раствор карбоната натрия, раствор силикатного клея; штативы с пробирками; образцы природных соединений кремния ( гранит, горный хрусталь, кварц и др.), образцы изделий из стекла, фаянса, фарфора, керамики. Ход урока: 1.Организационный момент. -Здравствуйте, ребята! Садитесь. Сегодня у нас открытый урок и у нас на уроке присутствуют гости. Давайте мы им улыбнемся и пожелаем доброго дня. На уроке мы с вами повторим пройденный материал, познакомимся с темой «Кремний и его соединения», решим задачи, проведем опыты. 2. Повторение пройденной темы. -На предыдущих уроках мы с вами познакомились с углеродом и с его соединениями. Давайте, мы с вами повторим. Для этого выполним задания ГИА. Задание № 1. (А) Число электронов во внешнем электронном слое атома с зарядом ядра +6 равно: 1) 6 2) 3 3) 4 4) 2 Задание № 2 Кислотным оксидом является: 1) CO2 2)Al2 O3 3) Na 2O 4) NO Задание № 3 Оксид углерода (IV) взаимодействует с 1) NaCl 2) P2 O5 3) Ca(OH)2 4) HNO3 Задание № 4 (В 1) В ряду химических элементов Ge – Si – C увеличиваются радиусы атомов увеличивается электроотрицательность усиливаются кислотные свойства их высших оксидов возрастает значение высшей степени окисления увеличивается число электронов во внешнем электронном слое атомов Задание № 5 (С2) К избытку карбоната кальция добавили 146 г раствора с массовой долей соляной кислоты 5 %. Вычислите объем (н.у.) выделившегося газа. Ответ: 2,24 л. Молодцы, ребята! 3.Новая тема. - Сегодня мы познакомимся с ещё одним неметаллом, значимость которого очень велика, т.к. по распространенности на Земле он второй после кислорода, - это кремний. Дадим характеристику этому химическому элементу: (Слайд) (сообщение одного из обучающихся, работа с периодической системой) 1.Строение. Кремний – элемент IV группы и 3-го периода, порядковый номер 14, А=28, 14 протонов и 14 нейтронов, 14 электронов. Строение его электронной оболочки следующая: 14 Si 2e 8e 4e 2. Нахождение в природе. (материал по этому вопросу может быть подготовлен и освещён обучающимися) - Земная кора на одну четверть состоит из соединений кремния. Наиболее распространённым является оксид кремния (IV) – кремнезём. В природе он образует минерал кварц и многие другие разновидности: горный хрусталь, аметист, агат, опал, яшма, халцедон, сердолик (полудрагоценные камни), а также обычный кварцевый песок . Именно кремень положил начало каменному веку. Причин этому две: доступность и распространённость, а также способность образовывать на сколе острые режущие края. Второй тип природных соединений кремния – силикаты. Самые распространённые алюмосиликаты: гранит, различные виды глин, слюды (слайд 7) Не содержащий алюминия силикат – асбест ( из него изготавливают огнестойкие ткани) Оксид кремния (IV) необходим и растениям, и животным. Он придаёт прочность стеблям растений и покровам животных ( камыши твёрдо стоят, осока режет, как лезвие, чешуя рыб, панцири насекомых, крылья бабочек, перья птиц, шерсть животных содержат оксид кремния (IV). ( слайд 8) Кремний придаёт гладкость и прочность костям человека, входит в состав низших живых организмов – диатомовых водорослей и радиолярий (образует их скелеты) ( слайд 9) 3. Открытие кремния. (материал по этому вопросу может быть подготовлен и освещён обучающимися) - Уже в глубокой древности люди широко использовали в своём быту соединения кремния. Вспомните древних людей. Из чего были изготовлены их орудия труда? Но сам кремний впервые был получен в 1824 г. Шведским химиком И.Я. Берцелиусом. Однако, за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнён примесями. Латинское название «силициум» берёт своё начало от латинского «силекс» - камень. С греческого языка «кремнос» - утёс, скала. 4. Физические свойства (слайд 12) (материал по этому вопросу может быть подготовлен и освещён учащимися) - Вы обратили внимание, что когда мы говорим о содержании в природных условиях элемента кремния, то упоминаем только его соединения, но не простое вещество. Кремний в свободном виде в природе не встречается в отличие от углерода (алмаз, графит, аморфный С и т.д.) кремний – неметалл, существует в кристаллическом и аморфном виде. Кристаллический кремний – серовато-стального цвета с металлическим блеском, твёрдый (7 баллов по шкале Мооса), но хрупкий, малореакционноспособный; полупроводник, (с повышением температуры электропроводность повышается), и с нарушением правильности структуры. Такие свойства обусловлены строением кристаллов, аналогичным структуре алмаза. Физические константы: g = 2,33 г/см3; t пл.= 1415 0С; t кип.= 3500 0С Аморфный кремний представляет собой белый порошок. 5. Получение кремния (слайд 13) - Способы получения кремния основаны в основном на восстановлении оксида кремния (IV) сильными восстановителями – активными металлами (Mg, Al) и углеродом. Лабораторный способ: SiO2 + 2Mg = 2MgO + Si Промышленный способ: 1900oC S  iO2 + 2C 2CO + Si iO2 + 2C 2CO + Si SiCi4 + 2Zn = 2ZnCi2 + Si 6. Химические свойства (слайд 14) а) кремний - восстановитель Все реакции протекают при нагревании! Si + O2 = SiO2 (оксид кремния (IV)) S 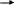 i0 – 4e- Si+4 восстановитель i0 – 4e- Si+4 восстановитель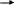 O2 + 4e- 2O-2 окислитель O2 + 4e- 2O-2 окислительSi + 2Cl2 = SiCl4 (хлорид кремния) Si + 2S = SiS2 (сульфид кремния) 20000C S  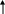 i + C Si+4C-4 (карбид кремния или карборунд, по твёрдости близок к алмазу) i + C Si+4C-4 (карбид кремния или карборунд, по твёрдости близок к алмазу)S 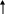 i + 2H2O(пар) = SiO2 + H2 i + 2H2O(пар) = SiO2 + H2Si + 2NaOH(конц.) + H2O = Na2SiO3 + 2H2 б) кремний – окислитель Si + 2Ca = Ca2Si (силицид кальция) Вывод: свойства кремния и углерода похожи. Оба неметалла взаимодействуют с кислородом, галогенами, серой, металлами. Но в отличие от углерода кремний напрямую не соединяется с водородом. 7. Соединения кремния Свойства кремнезёма (слайд15,16) Учитель подробно рассматривает свойства оксида кремния (IV) и проводит сравнительный анализ двух оксидов – SiO2 и CO2. результаты обсуждения в виде таблицы выводятся на экран. Обратите внимание на одно важное свойство оксида кремния: SiO2 + 4HF = 2H2O + SiF4 Оксид кремния входит в состав стекла, поэтому плавиковую кислоту нельзя хранить в стеклянной посуде. Вывод: физические свойства оксидов резко отличаются, т.к. они образуют разные кристаллические решётки – молекулярную (CO2) и атомную (SiO2), но химические свойства схожи. Отличие состоит в различном отношении к воде. Силан SiH4 (слайд 17) - 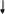 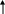 Силан получают косвенно, действуя на силициды металлов водой или кислотами: Силан получают косвенно, действуя на силициды металлов водой или кислотами:Mg2Si + 4H2O = 2Mg(OH)2 + SiH4 Силан – бесцветный газ, самовоспламеняющийся на воздухе и сгорающий с образованием оксида кремния и воды: SiH4 + 2O2 = SiO2 + 2H2O Кремниевая кислота и её соли (слайд 18) -кремниевая кислота H2SiO3 -единственная нерастворимая неорганическая кислота, - двухосновная, -  слабая H2SiO3 H2O +SiO2 слабая H2SiO3 H2O +SiO2 При высыхании образует силикагель, используемый в качестве адсорбента. Получить кремниевую кислоту можно только из её солей. Проведение лабораторного опыта и составление уравнения реакции получения кремниевой кислоты (самостоятельно, на доске) 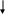 Na2SiO3 + 2HCl = 2NaCl + H2SiO3 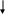 SiO32- + 2Н+ = H2SiO3 Соли кремниевой кислоты называют силикатами (слайд 19). Их можно получить сплавлением оксида кремния с оксидами металлов или карбонатами: S  iO2 + CaO = CaSiO3 iO2 + CaO = CaSiO3SiO2 + CaCO3 = CaSiO3 + CO2 8. Применение соединений кремния в народном хозяйстве (слайды 20,21,22) Для получения полупроводников. Кислотоупорных сплавов. Стекло, цемент, бетон, железобетон, кирпич, фарфор, фаянс. Закрепление. Работа с учебником. Задание № 4, стр. 185 Напишите уравнения реакций с помощью которых можно осуществить следующие превращения: SiO 2 - Si - Ca 2 Si - SiH 4 - SiO 2 - Si 9. Заключительные выводы (слайд 23)  |
