билет №9. Кристаллизация металлов и сплавов Кристаллизация металлов и сплавов
 Скачать 186.64 Kb. Скачать 186.64 Kb.
|
|
БИЛЕТ №9 Кристаллизация металлов и сплавов 3. Кристаллизация металлов и сплавов 3.1. Энергетические условия процесса кристаллизации В зависимости от температуры любое вещество (система) может быть в твердом, жидком или в газообразном состояниях. В физической химии системой называют совокупность индивидуальных веществ (химические элементы, независимые химические соединения), между которыми или частями которых обеспечена возможность обмена энергией, а также процессов диффузии. Вещества, которые образуют систему, называются компонентами системы. Компоненты в системе присутствуют в разных фазах. Фазой называется однородная часть системы, ограниченная от других частей системы поверхностью раздела, при переходе через которую свойства изменяются скачком. Процесс перехода из жидкого или газообразного состояния в твердое, в результате чего образуется кристаллическая решетка и возникают кристаллы, называется кристаллизацией. Чем объясняется существование при одних температурах жидкого, а при других температурах твердого состояния и почему превращение происходит при строго определенных температурах? В природе все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии. Энергетическое состояние системы, имеющей огромное число охваченных тепловым движением частиц (атомов, молекул), характеризуется особой термодинамической функцией (F ), называемой свободной энергией, которая определяется: F= U – TS, где U – внутренняя энергия системы; Т - абсолютная температура; S - энтропия Можно сказать, что чем больше свободная энергия системы, тем система менее устойчива, и если имеется возможность, то система переходит в состояние, где свободная энергия меньше. С изменением внешних условий, например температуры, свободная энергия системы изменяется по сложному закону, но различно для жидкого и твердого состояний (рис. 3.1). 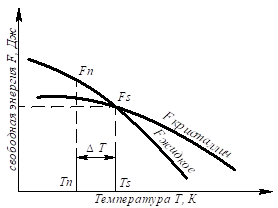 Рис. 3.1. Изменение свободной энергии жидкого и кристаллического состояний в зависимости от температуры Выше температуры Тs меньшей свободной энергией обладает вещество в жидком состоянии, ниже Ts – вещество в твердом состоянии. Следовательно, выше Ts вещество должно находиться в жидком состоянии, а ниже Ts – в твердом, кристаллическом. Очевидно, что при температуре, равной Ts свободные энергии жидкого и твердого состояний равны, металл в обоих состояниях находится в равновесии. Эта температура Ts и есть равновесная или теоретическая температура кристаллизации. Однако, при Ts Fж = Fкр, и процесс кристаллизации (плавления) не может идти, так как при равенстве свободных энергий обеих фаз плавление (кристаллизация) не будут сопровождаться уменьшением свободной энергии. Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Их кривых (рис. 3.1) видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки Ts. Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации. Охлаждение жидкости ниже температуры кристаллизации называется переохлаждением. Обратное превращение из кристаллического состояния в жидкое может произойти только выше температуры Ts, это явление называется перенагреванием. Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации T = Ts - Tф. Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура (рис. 3.2). 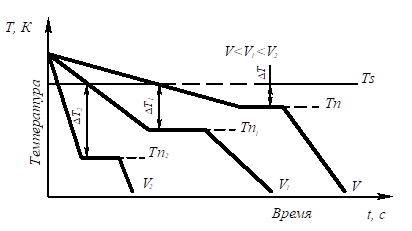 Рис. 3.2. Кривые охлаждения, полученные при кристаллизации металла Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением, так как при этом нет качественного изменения состояния. При достижении температур кристаллизации на кривой температура – время появляются горизонтальные площадки (рис.3.2), так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации. 3.2. Механизм процесса кристаллизации Процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые называются зародышами или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров. Модель кристаллизации металла в первые 7 секунд охлаждения представлена схемой процесса кристаллизации (рис.3.3) и кинетической кривой кристаллизации (рис.3.4). 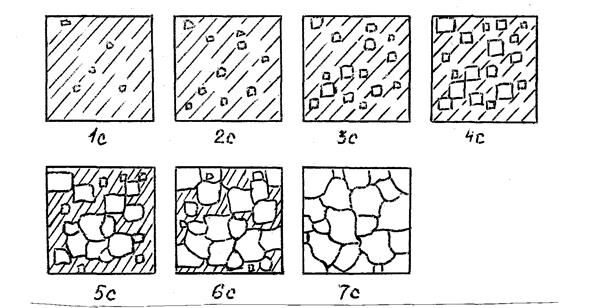 Рис. 3.3. Схема процесса кристаллизации 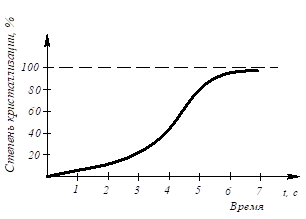 Рис. 3.4. Кинетическая кривая кристаллизации По мере развития кристаллизации в нем участвуют все большее и большее число кристаллов. Поэтому процесс вначале ускоряется, пока в какой-то момент взаимное столкновение растущих кристаллов начинает заметно препятствовать их росту. Рост кристаллов замедляется еще и потому, что количество жидкости, в которой образуются новые кристаллы, становится все меньше. В процессе кристаллизации, пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и срастании кристаллов их правильная форма нарушается. Внешняя форма кристалла оказывается зависимой от условий соприкосновения растущих кристаллов. Вот почему кристаллы металла - зерна (кристаллиты) не имеют правильной формы. Скорость всего процесса кристаллизации количественно определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов (рис.3.5). 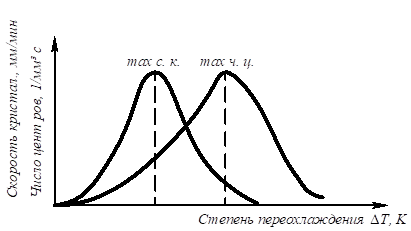 Рис. 3.5. Зависимость скорости кристаллизации (СК) и скорости зарождения центров кристаллизации (ЧЦ) от степени переохлаждения Величины оптимального переохлаждения до достижения максимальной скорости кристаллизации (СК) и до образования максимального числа центров кристаллизации (ЧЦ) не совпадают. Размер образовавшихся кристаллов зависит от соотношения СК и ЧЦ. При большом значении СК и малом значении ЧЦ образуется мало крупных кристаллов. При малых значениях СК и больших ЧЦ образуется большое число мелких кристаллов. Размер зерна определяется по формуле N = k Ö СК / ЧЦ, где N – размер зерна; k - коэффициент пропорциональности; СК – скорость кристаллизации; ЧЦ – число центров кристаллизации Минимальный размер способного к росту зародыша называется критическим размером зародыша. 3.3. Аморфное состояние металлов В соответствии с кривыми зависимости скорости кристаллизации и скорости зарождения центров кристаллизации от степени переохлаждения (рис. 3.5), при сверхвысоких скоростях охлаждения из жидкого состояния (> 106 оС/с) диффузионные процессы настолько замедляются, что подавляется образование зародышей и рост кристаллов, жидкость сохраняется не превращенной, не закристаллизовавшейся. В этом случае при затвердевании образуется аморфная структура. Материалы с такой структурой получили название аморфные сплавы или металлические стекла. Аморфное состояние обеспечивает металлическим материалам свойства, значительно отличающиеся от свойств соответствующих материалов с кристаллической структурой. Аморфные металлические материалы удачно сочетают высокие прочность, твердость и износостойкость с хорошей пластичностью и коррозионной стойкостью. Большое практическое значение имеет также и возможность получения аморфных металлов в виде ленты, проволоки диаметром несколько микрометров непосредственно при литье, минуя такие дорогостоящие операции, как ковка, прокатка, волочение, промежуточные отжиги, зачистки, травление. Затвердевание с образованием аморфной структуры принципиально возможно практически для всех металлов. В настоящее время аморфная структура получена у более чем 20 чистых металлов и полупроводниковых материалов и более 110 сплавов. Сверхвысокие скорости охлаждения для получения аморфной структуры можно получить такими способами, как катапультирование капли на холодную пластину, центрифугирование капли или струи, распыление струи газом или жидкостью с высокой охлаждающей способностью и др. Наиболее эффективными способами получения лент, пригодных для практического применения, считают охлаждение жидкого металла на внешней или внутренней поверхностях вращающихся барабанов, изготовленных из материалов высокой теплопроводности, прокатку между холодными валками металла, подаваемого в виде струи. Тонкий слой аморфного металла получают при расплавлении поверхности изделий лазерным лучом благодаря быстрому отводу теплоты при затвердевании массой основного металла. Металлические материалы с аморфной структурой можно получить не только при затвердевании из жидкого состояния, но и путем сверхбыстрого охлаждения из газовой среды (парообразного или ионизированного состояния), электролизом и катодным распылением с высокими скоростями осаждения. 3.4. Реальная форма кристаллических образований Реально протекающий процесс кристаллизации усложняется действием различных факторов: - скорости и направления отвода тепла; - наличия нерастворившихся частиц (центров кристаллизации); - конвекционных токов жидкости. В направлении отвода тепла кристалл растет быстрее, чем в другом направлении. Если на боковой поверхности растущего кристалла возникнет бугорок, то кристалл приобретает способность расти и в боковом направлении. В результате образуется древовидный кристалл, так называемый дендрит (рис.3.6). 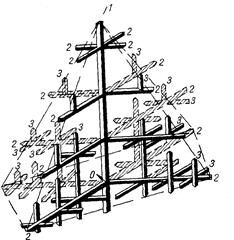 Рис. 3.6. Схема строения дендрита: 1, 2 и 3 – оси соответственно первого, второго и третьего порядков Дендритное строение типично для литого металла. Дендрит состоит из ствола (ось первого порядка), от которого идут ветви (оси второго и третьего порядков). Чем быстрее было охлаждение при кристаллизации, тем меньше размеры (высота) дендрита и меньше расстояния между ветвями второго порядка. Если условия благоприятны, охлаждение медленное, то могут вырасти огромного размера дендриты. В обычных слитках массой в сотни килограммов или несколько тонн, дендриты имеют размеры несколько десятков миллиметров и меньше. 3.5. Получение монокристаллов Большое научное и практическое значение имеют монокристаллы, которые отличаются минимальными структурными несовершенствами. Получение монокристаллов позволяет изучать свойства металлов, исключив влияние границ зерен. Монокристаллы можно получить, если создать условия для роста кристалла только из одного центра кристаллизации. Существует несколько методов, в которых использован этот принцип. Важнейшими из них являются методы Бриджмена и Чохральского (рис. 3.7). 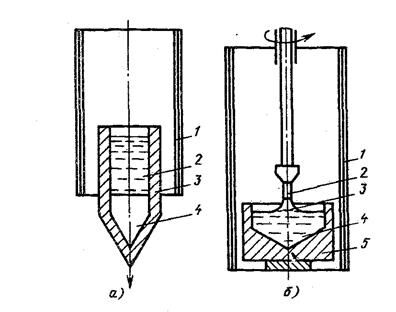 Рис. 3.7. Схемы установок для выращивания монокристалла: а – метод Бриджмена; б – метод Чохральского Метод Бриджмена (рис.3.7а) состоит в следующем: металл, помещенный в тигель с коническим дном 3, нагревается в вертикальной трубчатой печи 1 до температуры на 50-100 оС выше температуры его плавления. Затем тигель с расплавленным металлом 2 медленно удаляется из печи. Охлаждение наступает в первую очередь в вершине конуса, где и появляются первые центры кристаллизации. Монокристалл 4 вырастает из того зародыша, у которого направление преимущественного роста совпадает с направлением перемещения тигля. При этом рост других зародышей подавляется. Для непрерывного роста монокристаллов необходимо выдвигать тигель из печи со скоростью, не превышающей скорость кристаллизации данного металла. Метод Чохральского (рис. 3.7б) состоит в вытягивании монокристалла из расплава. Для этого используется готовая затравка 2 – небольшой образец, вырезанный из монокристалла по возможности без структурных дефектов. Затравка вводится в поверхностный слой жидкого металла 4, имеющего температуру чуть выше температуры плавления. Плоскость затравки, соприкасающаяся с поверхностью расплава, должна иметь кристаллографическую ориентацию, которую желательно получить в растущем монокристалле 3 для обеспечения наибольших значений тех или иных свойств. Затравку выдерживают в жидком металле для оплавления и установления равновесия в системе жидкость – кристалл. Затем затравку медленно, со скоростью, не превышающей скорости кристаллизации (»1-2 мм/мин), удаляют из расплава. Очень перспективно выращивание монокристаллов в космосе, где удачно сочетаются глубокий вакуум и невесомость. Монокристаллы, выращенные в космосе, совершеннее по структуре и распределению легирующих добавок (примесей), лучше по свойствам и значительно больше по размерам. 3.6. Жидкие кристаллы Жидкие кристаллы – это жидкости с упорядоченной молекулярной структурой. Благодаря упорядочению молекул они занимают промежуточное положение между кристаллами и обычными жидкостями с беспорядочным расположением молекул. Жидкие кристаллы текучи, как обычные жидкости, но в то же время обладают анизотропией свойств, как кристаллы. Известно несколько сотен жидких кристаллов, важное место среди них занимают некоторые органические вещества, у которых молекулы имеют удлиненную форму. По структуре жидкие кристаллы разделяют на три класса (рис. 3.8): - I (нематические); - II (смектические); - III (холестерические). 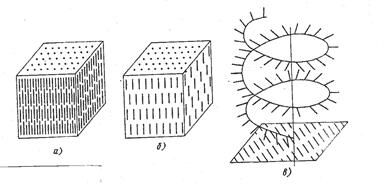 Рис. 3.8. Типы структур жидких кристаллов: а – нематические; б – смектические; в - холестерические Ориентационный порядок в расположении молекул создает анизотропию: показатель преломления света, диэлектрическая проницаемость, удельное электрическое сопротивление, вязкость и многие другие свойства зависят от направления, вдоль которого измеряют их величины, например, параллельно или перпендикулярно осям молекул. Структура жидких кристаллов легко изменяется под действием давления, электрического поля, нагрева. Это явление дает возможность управлять их свойствами путем слабых воздействий и делает жидкие кристаллы незаменимыми материалами для изготовления особо чувствительных индикаторов. Способность изменять оптические свойства жидких кристаллов первого класса, а также кристаллов третьего класса под влиянием электрического поля и температурных условий широко используется в приборостроении. В жидких кристаллах первого класса наблюдается электрооптический эффект динамического рассеяния света. Жидкие кристаллы используют в цветных индикаторах и других цветовых устройствах. Для цветных изображений применяют смеси жидких кристаллов с красителями, также имеющими продолговатые молекулы. На основе жидких кристаллов изготовляют медицинские термометры, датчики температуры для контроля перегрева узлов и деталей, преобразователи невидимого инфракрасного излучения в видимый свет. В последнем случае поглощение инфракрасного излучения нагревает жидкий кристалл так, что изменяется окраска отраженного света. Жидкие кристаллы применяют в модуляторах, системах отображения информации – калькуляторах, ручных часах, измерительных приборах автомобилей, устройствах для отклонения светового потока и др. 3.7. Строение стального слитка Различные сочетания факторов, влияющих на кристаллизацию, приводят к своеобразной структуре стальных слитков. Типичная структура слитка состоит из трех основных зон (рис.3.9). 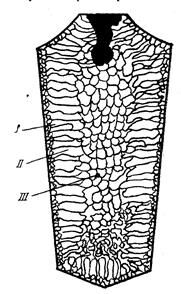 Рис. 3.9. Схема строения стального слитка Первая зона – наружная мелкозернистая корка I, состоящая из дезориентированных мелких кристаллов – дендритов. При первом соприкосновении со стенками изложницы в тонком прилегающем слое жидкого металла возникает резкий градиент температур и , как следствие, явление переохлаждения, ведущее к образованию большого количества центров кристаллизации. В результате корка получает мелкозернистое строение. Вторая зона – зона столбчатых кристаллов II. После образования самой корки условия теплоотвода меняются (из-за теплового сопротивления, из-за повышения температуры стенки изложницы и других причин), градиент температур в прилегающем слое жидкого металла резко уменьшается и, следовательно, уменьшается степень переохлаждения стали. В результате, из небольшого числа центров кристаллизации начинают расти нормально ориентированные к поверхности корки (т.е. в направлении отвода тепла) столбчатые кристаллы. Третья зона слитка – зона равноосных кристаллов III. В центре слитка уже нет определенной направленности отдачи тепла. Температура застывающего металла успевает почти уравняться в различных точках, и жидкость обращается как бы в кашеобразное состояние вследствие образования в различных ее точках зачатков кристаллов. Далее зачатки разрастаются осями – ветвями по различным направлениям, встречаясь друг с другом. В результате этого процесса образуется равноосная структура. Зародышами кристалла здесь являются обычно различные мельчайшие включения, присутствующие в жидкой стали или случайно в нее попавшие, или не растворившиеся в жидком металле. Применяя различные технологические приемы, можно изменить количественное соотношение зон или исключить из структуры слитка какую-либо зону вообще (рис.3.10). 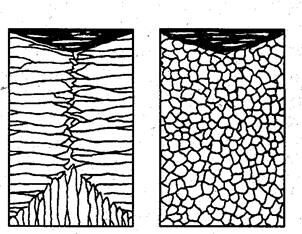 а б Рис. 3.10. Схемы макроструктур слитков: а – столбчатые кристаллы; б – равноосные кристаллы Например, перегрев сплавов перед разливкой и быстрое охлаждение при кристаллизации приводят к формированию структуры, состоящей практически из одних столбчатых кристаллов (рис.3.10а). Такая структура называется транскристаллической. Подобную структуру имеют слитки очень чистых металлов. Зона столбчатых кристаллов характеризуется наибольшей плотностью, но в месте стыка столбчатых кристаллов собираются нерастворимые примеси, и слитки с транскристаллической структурой часто растрескиваются. Транскристаллическая структура в сварных швах уменьшает прочность. На практике для измельчения структуры металлов и сплавов широко применяют технологическую операцию, называемую модифицированием. Она состоит во введении в жидкий сплав перед разливкой специальных добавок (модификаторов). В качестве модификаторов используют поверхностно-активные вещества (например, бор в стали, натрий в алюминии и его сплавах) и элементы, образующие тугоплавкие тонкодисперсионные частицы (например, титан, цирконий в алюминии и его сплавах; алюминий, титан в стали). Модификаторы добавляют в сплавы в количествах от тысячных до десятых долей процента. Слитки сплавов имеют неоднородный состав. Неоднородность сплава по химическому составу, структуре и неметаллическим включениям, образующаяся при кристаллизации слитка, называется ликвацией. Химическая неоднородность по отдельным зонам слитка называется зональной ликвацией. Она отрицательно влияет на механические свойства. В реальных слитках помимо зональной встречаются и другие виды ликвации: внеосевая, дендритная, карбидная, подусадочная, угловая, гравитационная. Так, гравитационная ликвация образуется в результате разницы в удельных весах твердой и жидкой фаз, а также при кристаллизации несмешивающихся жидких фаз. Жидкий металл имеет больший объём, чем закристаллизовавшийся, поэтому залитый в форму металл в процессе кристаллизации сокращается в объёме, что приводит к образованию пустот, называемых усадочными раковинами. Усадочные раковины могут быть сконцентрированы в одном месте, либо рассеяны по всему объёму слитка или по его части. Они могут быть заполнены газами, растворимыми в жидком металле, но выделяющимися при кристаллизации. В хорошо раскисленной, так называемой спокойной стали, отлитой в изложницу с утепленной подложкой, усадочная раковина образуется в верхней части слитка и в объёме всего слитка содержится малое количество газовых пузырей и раковин. Недостаточно раскисленная, так называемая кипящая сталь, содержит раковины и пузыри во всем объёме. Поэтому спокойный металл более плотный, чем кипящий. 3.8. Методы исследования структуры Исследование структуры металлов может проводиться: - методом световой микроскопии; - методом электронной микроскопии; - рентгеноструктурный анализ; - рентгеноспектральный анализ; - дополнительные методы исследования. При методе световой микроскопии с помощью различных микроскопов можно увидеть размер, форму и взаимное расположение зерен, достаточно крупные включения, некоторые крупные дефекты кристаллического строения. Для исследования готовят микрошлифы (поверхность образца должна быть отполирована до зеркального блеска, а затем протравлена специальными реактивами). Метод электронной микроскопии проводится с помощью электронных микроскопов, которые делятся на просвечивающие электронные микроскопы (ПЭМ) и растровые электронные микроскопы (РЭМ). Метод основан на прохождении, преломлении, рассеивании и отражении электронного пучка от поверхности исследуемого микрошлифа. При этом можно увидеть детали структуры менее 0,1мкм, однако, этот метод требует сложной подготовки образца, особенно при исследовании на просвечивающем электронном микроскопе. Рентгеноструктурный анализ изучает строение решетки и основан на исследовании микрошлифа путем рассеивания рентгеновских лучей. Ещё посмотрите лекцию "10.4 Выводы по сравнению, повторению, рандомизации и разделению на блоки" по этой теме. Методом спектрального анализа и аналитической химии можно определить состав сплава, при этом достигается высокая точность при определении распределения компонентов. К дополнительным методам для определения тонкой структуры металлов и сплавов, включая дефекты типа вакансий и дислокаций, относятся: - нейтронография; - ядерный гамма-резонанс; - автоионная микроскопия; - оже-электронная спектроскопия. |
