Определение железа в воде. определение железа. Курсовая работа Фотометрическое определение железа в питьевой воде
 Скачать 115.96 Kb. Скачать 115.96 Kb.
|
|
Министерство науки и высшего образования ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «УДМУРТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» Институт естественных наук Кафедра фундаментальной и прикладной химии Курсовая работа «Фотометрическое определение железа в питьевой воде» Направление подготовки 04.03.01-химия СОДЕРЖАНИЕ 1 ВВЕДЕНИЕ Проблема загрязнения природных вод в настоящее время становится все более актуальной. Одним из загрязнителей, ухудшающих качество воды является железо. Предельно допустимая концентрация (ПДК) суммарного железа в питьевой воде, согласно СанПиН, составляет 0,3 мг/дм3. Для определения железо в одной из степеней окисления (II) или (III) используются фотометрические методы анализа [1]. Цель работы: фотометрическое определение железа в питьевой воде сульфосалициловым методом. Задачи курсовой работы: - проработка литературного материала; - рассмотрение метода фотометрического определения железа; - определение содержания железа в питьевой воде фотометрическим методом. 2 ЛИТЕРАТУРНЫЙ ОБЗОР 2.1 Основные понятия фотометрии Фотометрия - совокупность оптических методов и средств измерения фотометрических величин светового потока. Основным понятием фотометрии является поток излучения, смысл которого в мощности переносимого электромагнитного (оптического) излучения. Спектрофотометрия - определение зависимости фотометрических величин от длины волны излучения. Спектроскопия или эмиссионный спектральный анализ - определение излучательной способности веществ в зависимости от длины волны излучения. В аналитической химии и клинической лабораторной диагностике широкое применение нашли фотометрические методы количественного анализа. Они основаны на переведении определяемых компонентов в поглощающие свет соединения с последующим определением их количеств путем измерения светопоглощения растворов [2]. По окраске растворов окрашенных веществ можно определять концентрацию компонентов при помощи фотоэлектрических приемников оптического излучения (фотоприемников) - приборов, превращающих световую энергию в электрическую. Если измерение ведется без выделения узкого диапазона длин волн, то есть измеряются характеристики всего светового потока, то такой метод анализа часто называется колориметрическим. Если же выделяется характерный для поглощения данным веществом оптический диапазон и измерение проводится на определенной длине волны, тогда говорят о собственно фотометрическом методе анализа. Фотометрический метод является более объективным методом, чем колориметрический, поскольку результаты его меньше зависят от поглощения света другими (интерферирующими) окрашенными веществами [13]. Фотометрический анализ - один из самых старых и распространенных физико - химических методов. Для него требуется относительно простое оборудование, в то же время он характеризуется высокой чувствительностью и возможностью определения большого количества органических веществ. Открытие все новых и новых реагентов, образующих окрашенные соединения с неорганическими ионами и органическими веществами, разработка принципов сопряженных реакций делает в настоящее время применение этого метода почти неограниченным. Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных веществ, так и для определения микропримесей в объектах. Комбинирование с некоторыми методами разделения и обогащения - хроматографическим, экстракционным, позволяет на несколько порядков повысить чувствительность фотометрических методов. Фотометрические свойства растворенного вещества характеризуются коэффициентом пропускания T (τ), коэффициентом отражения R (ρ), и коэффициентом поглощения A (α), которые для одного и того же вещества связаны соотношением (1): T + R + A = 1…… (1) Определение безразмерных величин T, R и A выполняется с помощью фотометров (приборов для измерения какой-либо фотометрической величины) путем регистрации реакций приемника оптического излучения на соответствующие потоки излучения. Фотометрические методы применяются также в тех случаях, когда изучается способность веществ рассеивать (нефелометрия) и пропускать излучение (турбидиметрия), переизлучать поглощенное излучение (флуориметрия), изменять степень поляризации излучения при прохождении его через оптически активные вещества (поляриметрия). Кроме того, одним из важных разделов физической оптики является рефрактометрия, изучающая показатели преломления оптического излучения твердых, жидких и газообразных веществ в зависимости от длины волны излучения. Названные оптические методы применяются для изучения состояния биологических систем и их изменения в процессах ассоциации-диссоциации, взаимодействия с другими молекулами, образования и распада комплексов фермент - субстрат, антиген - антитело, белок-липид, белок-нуклеиновая кислота; фотофизических и фотохимических процессов и т.д.[1]. 2.2 Классификация методов фотометрического анализа Метод анализа, основанный на переведении определяемого компонента в поглощающее свет соединение с последующим определением количества этого компонента путём измерения светопоглощения раствора полученного соединения, называется фотометрическим. По окраске растворов окрашенных веществ можно определять концентрацию того или иного компонента или визуально, или при помощи фотоэлементов - приборов, превращающих световую энергию в электрическую. В соответствии с этим различают фотометрический визуальный метод анализа, называемый часто колориметрическим, и метод анализа с применением фотоэлементов - собственно фотометрический метод анализа. Фотометрический метод является объективным методом, поскольку результаты его не зависят от способностей наблюдателя, в отличие от результатов колориметрического - субъективного метода. Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных технических объектов с содержанием до 20 - 30% определяемого компонента, так и для определения микропримесей в этих объектах при содержании их до 103 104 %. Комбинирование фотометрических методов с некоторыми методами разделения - хромотографическим, экстракционным позволяет на 1-2 порядка повысить чувствительность определения, доведя его до 105. В некоторых случаях фотометрический метод может быть применён для одновременного определения в растворе в растворе нескольких ионов, хотя его возможности ограничены. Очень ценно использование фотометрических методов для решения многих теоретических вопросов аналитической и физической химии [6]. Фотометрический метод количественного анализа основан на переведении определяемого компонента в поглощающее свет соединение; количество этого продукта реакции устанавливают путем измерения светопоглощения. В фотометрическом анализе применяют реакции различных типов. Для определения неорганических компонентов чаще всего используют реакции образования (иногда - разрушения) окрашенных комплексных соединений. Большинство металлов и неметаллов способны к образованию различных комплексных соединений, в том числе окрашенных, или во всяком случае способны к взаимодействию с окрашенными комплексами. Поэтому область применения фотометрических методов анализа практически не имеет ограничений; в настоящее время известны достаточно простые фотометрические методы определения почти всех элементов или их соединений. Для фотометрического определения органических компонентов чаще всего используют реакции синтеза окрашенных соединений. Реакции синтеза удобно применять и для определения некоторых неорганических компонентов, например сульфидов или нитритов. Значительно реже применяют в фотометрическом анализе реакции окисления – восстановления. При определении неорганических компонентов важное значение имеет только окисление хрома до хромата и марганца до перманганата. Несколько чаще используют реакции окисления- восстановления в качестве вспомогательных, например, при определении фосфора или кремния в виде синих гетерополикомплексов. Довольно часто реакциями окисления- восстановления пользуются в различных стадиях фотометрического определения органических веществ. Наконец, ряд фотометрических методов основан на каталитическом эффекте. Чувствительность фотометрических методов, основанных на обычных реакциях образования окрашенных соединений, имеет естественный предел. Поэтому если необходимо значительное повышение чувствительности, поступают следующим образом. Определяемый компонент вводят в некоторую систему в качестве катализатора. В результате каждая частица определяемого компонента приводит к образованию большого количества частиц продукта реакции. Количество продукта каталитической реакции определяется фотометрическим методом. Таким образом, центральное место в фотометрическом анализе занимает химическая реакция. Время, затрачиваемое на анализ, чувствительность метода, его точность и избирательность зависят в основном от выбора химической реакции и оптимальных условий образования окрашенного соединения. Правильное измерение светопоглощения, разумеется, имеет большое значение. Однако выбор того или другого способа измерения поглощения света обусловлен, как правило, не особенностями анализируемого материала или выбранной реакцией, а общими условиями работы той или другой лаборатории. Различают, по крайней мере, три следующие группы способов измерений концентрации окрашенного соединения в растворе: 1.Визуальное сравнение. Глаз является весьма чувствительным устройством. Однако визуально нельзя установить количественно степень поглощения света или даже оценить, во сколько раз один раствор окрашен сильнее, чем другой. Глазом можно довольно хорошо установить равенство интенсивности окрасок или цвета двух растворов. Поэтому при каждом определении необходимо готовить стандартный раствор и добиваться одинаковой окраски испытуемого и стандартного растворов. Глаз наиболее чувствителен не к различию интенсивностей окрасок, а к различию цветов, оттенков. Поэтому такой способ установления содержания окрашенного продукта реакции называют колориметрическим анализом. 2. Инструментальные методы: а) Поглощение света измеряют при помощи приборов с фотоэлементом. Такие приборы называют фотоэлектроколориметрами (ФЭК). В отличие от визуального способа, с помощью ФЭК можно непосредственно измерить ослабление интенсивности первоначального светового потока. Поэтому нет необходимости каждый раз готовить стандартный раствор. Обычно при работе с ФЭК перед выполнением анализов составляют калибровочный график по серии стандартных растворов. Калибровочным графиком, пользуются для многих определений, что очень удобно для массовых однотипных анализов. Если поглощение света измеряют с помощью ФЭК, такой способ называют фотоколориметрическим анализом. б) Спектрофотометр - наиболее совершенный, хотя и более сложный прибор. В спектрофотометре ослабление интенсивности светового потока измеряется также с помощью фотоэлементов. Однако в спектрофотометре имеется призма или дифракционная решетка, а также щель. Это позволяет выделить узкий участок спектра, именно тот, которым «оптически реагирует» окрашенное соединение. Известно очень мало «серых веществ», поглощающих свет равномерно во всех участках спектра. Большинство же окрашенных веществ поглощает преимущественно какой-нибудь один участок спектра. Поэтому измерение при длине волны, соответствующей максимуму спектра поглощения, увеличивает чувствительность. Кроме того, облегчается определение одного окрашенного соединения в присутствии другого, иначе окрашенного; в частности, при работе со спектрофотометром значительно улучшаются результаты фотометрического определения с применением окрашенных реактивов. Приведенное выше разделение способов измерения светопоглощения не имеет резких границ. Так, в фотометре Пульфриха сравнение двух световых потоков выполняется визуально; однако более интенсивный поток ослабляется измерительной диафрагмой. В результате можно установить численное значение ослабления интенсивности светового потока. Далее, как фотометр Пульфриха, так и ФЭК обычно снабжаются набором светофильтров, что в известной степени приближает эти приборы к спектрофотометрам. Существенным преимуществом спектрофотометров является возможность изучения светопоглощения в отдельных участках спектра, т. е. наблюдения всего спектра поглощения, что очень важно для правильного выбора оптических условий измерения, а также для физико-химических характеристик окрашенных соединений [2]. Фотометрический анализ относится к молекулярному абсорбционному анализу, т.е. анализу основанному на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра. Спектрофотометрический метод анализа - основан на поглощении монохроматического излучения, т.е. излучения с одной длиной волны в видимой и УФ областях спектра. Фотоколориметрический метод анализа - основан на поглощении полихроматического (немонохроматического) излучения, т.е. пучка лучей с близкими длинами волны в видимой области спектра. Фотоколориметрию используют в основном для анализа окрашенных растворов. Оба метода основаны на общем принципе - пропорциональной зависимости между светопоглощением и концентрацией определяемых веществ. С помощью фотометрического анализа можно определять малые количества вещества, например, содержание примесей не ниже 5∙10-5 % (спектрофометрически) и 1∙10-4 % (фотоколориметрически) при погрешности определения 1-3 % [3]. 2.3 Спектры поглощения Как известно, внутренняя энергия молекулы складывается из трех основных составляющих: энергии движения электронов (Еэл.), энергии колебаний атомов молекулы (Екол.) и энергии вращения молекулы (Евр. ). Формула для расчета внутренней энергии (2): Е = Еэл + Екол + Евр (2) При поглощении излучения в видимой и УФ областях спектра происходит изменение электронной составляющей общей энергии. Поэтому мы будем рассматривать энергию движения электронов. Если излучение определенной длины волны проходит через вещество и не поглощается, то энергическое состояние молекулы остается без изменения. Если же излучение поглощается, то молекулы вещества переходят из одного энергетического состояния с меньшей энергией (Е1) в другое энергетическое состояние с большей энергией (Е2). Этот процесс сопровождается поглощением кванта энергии (3): ∆Е = Е2 Е1… …(3) v= c∙ν∙h где h - постоянная Планка (6,62 ∙10-34 Дж∙с), ν - частота излучения (с-1, Гц), с - скорость света (3 ∙1010 см/с), Формула для расчета волнового числа (4): ύ = 1 / l (4) где ύ - волновое число (см-1), l- длина волны, нм (1 нм = 10-9 м или в микронах 1 мк = 1·∙ 10-6 м). Энергия кванта определяет длину волны, а число поглощенных квантов - интенсивность излучения. Обычно энергию электронного перехода относят к молю вещества и выражают в кДж/моль. Зная длину волны и волновое число можно рассчитать энергию электронного перехода. В таблице 1 приведены основные области электромагнитного излучения. Таблица 1 Основные области электромагнитного излучения
Изучая поглощение излучения веществом различных длин волн в видимой и УФ областях спектра можно получить электронный спектр поглощения. Спектром поглощения называют графическую зависимость интенсивности поглощения от длины волны или волнового числа (ύ). Для каждого поглощающего вещества имеется определенное распределение интенсивности поглощения по длинам волн, при этом на кривой поглощения имеются один или несколько максимумов. Область интенсивного поглощения называется полосой поглощения. По спектру поглощения можно определить состав и строение соединений, т.к. различные функциональные группы характеризуются определенными полосами поглощения в спектре. К основным характеристикам полосы поглощения (рис. 1) относятся: длина волны в максимуме поглощения (lмакс), интенсивность поглощения в максимуме (Ɛ max), полуширина полосы (δ1/2), которая равна ширине полосы в единицах длин волн или волнового числа при значении интенсивности, составляющей половину интенсивности поглощения в максимуме [3]. 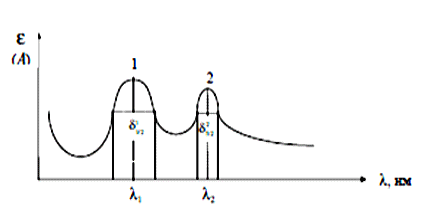 Рис 1 Электронный спектр поглощения молекулы При прохождении электромагнитного излучения интенсивностью I0 через частично поглощающую среду, например, через раствор с концентрацией поглощающего вещества С (моль/л) и толщиной поглощающего слоя l, часть этого излучения будет поглощаться (In), небольшая часть излучения отражается от стенок кюветы (Iотр.), и часть проходит через раствор (I) (рис. 2). 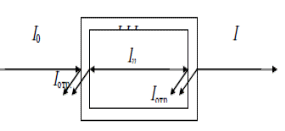 Рис 2 Схема поглощения света раствором Таким образом, интенсивность падающего излучения равна сумме трех составляющих (5): I0 = I + Iотр + In (5) Значение Iотр очень мало, поэтому это значение можно не учитывать [6]. 2.4 Аппаратура и техника фотометрических измерений Фотометрические методы определения концентрации веществ в растворах основаны на сравнении поглощения или пропускания света стандартными и исследуемыми растворами. Степень поглощения света измеряют с помощью фотоэлектроколориметров и спектрофотометров. Измерение оптической плотности производят по отношению к раствору сравнения (нулевого раствора). В качестве раствора сравнения чаще всего используют растворитель [3]. Н 3’ езависимо от области спектра приборы для измерения пропускания или поглощения света раствором состоят из следующих пяти основных узлов (рис. 3): 1 2 3 4 5 Рис 3 Основные узлы приборов для абсорбционных измерений Источника излучения (1), монохроматора (2), устройства, которое позволяет выделить ограниченную область длин волн, кювет с исследуемым раствором и раствором сравнения (3 и 3’) (приборы комплектуются набором кювет с l= 10 0,1 см), преобразователя (4), который превращает энергию излучения в электрический сигнал (фотоэлемент), индикатора сигнала (5) (регистрирующее устройство). Приборы, применяемые для измерения поглощения растворов, можно классифицировать следующим образом: по способу монохроматизации лучевого потока: приборы с призменным или решетчатым монохроматорами, которые позволяют достигнуть высокой степени монохроматизации рабочего излучения называют спектрофотометрами; приборы, в которых монохроматизация достигается с помощью светофильтров, называют фотоэлектроколориметрами. по способу измерения: однолучевые с прямой схемой измерения, и двулучевые с компенсационной схемой измерения. по способу регистрации измерений: регистрирующие и нерегистрирующие [3]. Фотоэлектроколориметры предназначены для измерения пропускания или оптической плотности растворов в диапазоне 315-630 нм и определения концентрации растворов фотоколориметрическим методом [3]. Спектрофотометры предназначены для измерения пропускания или оптической плотности в диапазоне 190-1100 нм. Источником УФ излучения служат водородная или дейтериевая лампа. Данные источники излучают сплошной спектр в интервале 180-375 нм. В одинаковых рабочих условиях дейтериевая лампа дает излучение большей интенсивности, чем водородная. Для измерения оптической плотности или пропускания в УФ области спектра требуются кюветы из кварцевого стекла, т. к. обычное стекло сильно поглощает это излучение [11]. Источником видимого излучения служит лампа накаливания с вольфрамовой нитью, излучающая сплошной спектр в области 315-1100 нм. В спектрофотометрах в качестве устройства для выделения части излучения применяют монохроматоры двух типов: призму и дифракционную решетку, которые позволяют непрерывно менять длину волны [13]. 2.5 Качественный и количественный анализ методом фотометрии Качественный фотометрический анализ. Молекулы различных веществ характеризуются своей системой энергетических уровней, поэтому спектры поглощения их будут различаться по числу полос поглощения, их положению в шкале длин волн и интенсивности. Этот факт используют для идентификации и проведения качественного анализа веществ, используя для этого значения lmax и Ɛmax, которые зависят от природы вещества. Ультрафиолетовые спектры поглощения обычно имеют две-три и более полос поглощения. Для идентификации исследуемого вещества записывают его спектр поглощения в различных растворителях и сравнивают полученные данные с соответствующими спектрами исходных веществ известного состава. Если спектры поглощения исследуемого вещества в разных растворителях совпадают со спектром известного вещества, то делают заключение об идентичности химического состава этих соединений. При идентификации вещества следует также обратить внимание на интенсивность поглощения. Очень многие органические вещества имеют полосы поглощения, максимумы которых расположены при одинаковой длине волны, но интенсивности их различны. Например, в спектре фенола наблюдается полоса поглощения при l= 255 нм, для которой Ɛ= 1450. При той же длине волны ацетон имеет полосу поглощения, для которой Ɛ= 17 [3]. Количественный фотометрический анализ. Концентрация исследуемого вещества может быть определена методом фотометрии в том случае, если в спектре поглощения раствора этого вещества имеются ясно выраженные полосы поглощения в УФ и видимой областях спектра. В основе количественного определения лежит закон Бугера-Ламберта-Бера, который устанавливает прямопропорциональную зависимость между оптической плотностью и концентрацией вещества в исследуемом растворе. С помощью фотометрии можно проводить анализ как индивидуальных веществ, так и их смесей. Методы определения индивидуальных веществ: метод градуировочного графика; метод стандартного раствора (метод сравнения); метод добавок; метод дифференциальной фотометрии; К фотометрическому методу анализа близко примыкает фотометрическое титрование. При этом часто используют те же реакции, что и в обычных фотометрических методах, и ту же аппаратуру. Однако о содержании определяемого вещества судят не по интенсивности светопоглощения, а по количеству затраченного реактива. Таким образом, фотометрическое титрование - это разновидность объемного анализа, при котором точку эквивалентности определяют с помощью фотоэлемента. При фотометрическом титровании необходимо, чтобы уже при эквивалентном количестве реактива было достигнуто практически полное связывание определяемого компонента. Поэтому, например, железо можно фотометрически титровать салицилатом натрия или ксиленоловым оранжевым, но нельзя титровать роданидом или хлоридом, которые образуют малопрочные комплексы. Фотометрическое титрование применяют в следующих случаях: а) если в результате титрования образуется окрашенное соединение; б) если изменение цвета индикатора происходит постепенно, без резкого цветового изменения; в) при титровании окрашенных растворов; г) при титровании веществ, поглощающих свет в ультрафиолетовой или ближней инфракрасной области; д) при титровании очень разбавленных растворов. Фотометрическое титрование проводят как с применением внутренних цветных индикаторов, так и в отсутствие индикаторов. В первом случае все закономерности, выведенные для визуального наблюдения точки эквивалентности, сохраняются и для фотометрического титрования. В начале титрования оптическая плотность раствора практически не изменяется. По мере приближения к точке эквивалентности, когда индикатор изменяет свои цвет, оптическая плотность раствора, измеряемая при определенной длине волны, начинает резко изменяться (уменьшаться или увеличиваться, в зависимости от выбранной длины волны). На основании данных титрования строят график в координатах: оптическая плотность (ось ординат) - объем израсходованного раствора (ось абсцисс). Точка пересечения двух прямых (точка перегиба) соответствует точке эквивалентности. Перпендикуляр, опущенный из этой точки на ось абсцисс, показывает количество миллилитров титрованного раствора, необходимое для достижения точки эквивалентности. Как и другие методы объемного анализа, фотометрическое титрование менее чувствительный метод, чем обычные фотометрические методы. Фотометрическое титрование, как правило, применяется для определения больших количеств веществ (порядка 0,01-0,001 г-экв) [2]. 3 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 3.1 Сущность и методика фотометрического определение железа с сульфосалициловой кислотой В качестве определяемого вещества выбрано железо (III). Измерения проводятся в следующих условиях: - температура окружающего воздуха (20 ± 5) С; - атмосферное давление (84,0 - 106,7) кПа (630 - 800 мм.рт.ст.); - относительная влажность (80 ± 5) %; - напряжение сети (220 ± 10) В; - частота переменного тока (50 ± 1) Гц. Методы отбора проб. Пробы воды отбирали по ГОСТ 2874. Объем пробы воды для измерения массовой концентрации железа должен быть не менее 200 см3. Способы консервирования, сроки и условия хранения проб воды, предназначенных для измерения массовой концентрации общего железа по ГОСТ 24481 [8]. Фотометрический метод определения массовой концентрации общего железа основан на образовании сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа 3+ (красное окрашивание), а в слабощелочной среде с солями железа (2+) и (3+) (желтое окрашивание). Оптическую плотность окрашенного комплекса для железа общего измеряют при длине волны λ=425 нм, для железа (3+), при длине волны λ=500 нм. 3.2 Оборудование и реактивы - спектрофотометр или фотоэлектроколориметр, позволяющий измерять оптическую плотность при длине волны λ=425 и λ=500 нм. - кюветы с толщиной рабочего слоя 10-50 мм. - весы аналитические лабораторные, класс точности 1, 2 по ГОСТ 24104. - колбы мерные 2-го класса, вместимостью 50, 100, 1000 см3 по ГОСТ 1770. - пипетки мерные без делений вместимостью 50 см3 и пипетки мерные с ценой наименьшего деления 0,1-0,05 см3, вместимостью 1, 5 и 10 см3 2-го класса по нормативно-техническому документу ГОСТ 29227. - колбы стеклянные лабораторные конические номинальной вместимостью 100 см3, типа Кн по ГОСТ 25336. - кислота азотная, ГОСТ 4461 - кислота серная, ГОСТ 4204 - аммоний хлористый по ГОСТ 3773. - аммиак водный по ГОСТ 3760, 25 %-ный раствор. - квасцы железоаммонийные по нормативно-техническому документу ТУ 6-09-5359 или ГОСТ 4205. - кислота соляная по ГОСТ 3118. - кислота сульфосалициловая по ГОСТ 4478. - вода дистиллированная по ГОСТ 6709. - натрий хлористый, ГОСТ 4233 - бумага индикаторная универсальная, ТУ-6-09-1181 Все реактивы, используемые для анализа, должны быть химически чистые (х. ч.) или чистые для анализа (ч.д.а). 3.3 Методика проведения анализа Подготовка прибора. Подготовку спектрофотометра или фотоэлектроколориметра к работе проводили в соответствии с рабочей инструкцией по эксплуатации прибора. Приготовление растворов Приготовление 20%-ного раствора сульфосалициловой кислоты. (20,0 г) сульфосалициловой кислоты растворили в мерной колбе вместимостью 100 см3 в небольшом количестве дистиллированной воды и довели этой водой до метки. Приготовление раствора аммиака (1:1) 100 см3 25 %-ного раствора аммиака прилили к 100 см3 дистиллированной воды и перемешали. Приготовление раствора хлористого аммония молярной концентрации 2 моль/дм3 107 г NH4Cl растворили в мерной колбе вместимостью 1 дм3 в небольшом количестве дистиллированной воды и довели этой водой до метки. Приготовление основного стандартного раствора железа из ГСО с аттестованным содержанием Раствор готовили в соответствии с прилагаемой к образцу инструкцией 1 дм3 раствора должен содержать 100 мг железа. Срок и условия хранения раствора по ГОСТ 4212 -один месяц. Приготовление рабочего стандартного раствора железа Рабочий раствор готовили в день проведения анализа разбавлением основного раствора в 10 раз дистиллированной водой. Построение градуировочного графика. Для построения градуировочного графика приготовили образцы для градуировки с массовой концентрацией железа от 0,1 до 10,00 мг/дм3. В мерные колбы на 100 см3 поместили рабочий раствор железа с концентрацией 0,00; 0,01; 0,02; 0,03; 0,04; 0 05 мг/см3 или аликвотная часть раствора (см3) 0,1,2,3,4,5, прилили 2,0 см3 аммония хлористого, 2,0 см3 сульфосалициловой кислоты, 2.0 см3 аммиака рН раствора должен составлять 7-8 (по индикаторной бумаге). Довели до метки дистиллированной водой. Тщательно перемешали и оставили на 5 мин до развития окраски. Оптическую плотность полученного раствора измеряли по длине волны λ=425 нм в кювете с длиной поглощающего слоя 50 мм по отношению к холостому раствору, проведенному с дистиллированной водой через весь ход анализа. По градуировочному графику находили содержание железа общего. Анализ образцов для градуировки провели в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных. При построении градуировочного графика по оси ординат откладывали значения оптической плотности, а по оси абсцисс - величину концентрации вещества в мг/дм3. Определение можно проводить только в тех случаях, когда пробу не обрабатывали, с целью разрушения органических компонентов, и не кипятили, т. к. при этом Fe(2+) окисляется до железа Fe(3+). Приготовление анализируемого раствора Пробу объемом 80,0 см3 и менее, в зависимости от концентрации, поместили в мерную колбу вместимостью 100 см3, нейтрализовали раствором аммиака до рН 3-5 по индикаторной бумаге, прибавили 2 см3 сульфосалициловой кислоты, довели до метки дистиллированной водой. Тщательно перемешали и оставили на 5 мин до полного развития окраски. Оптическую плотность полученного раствора измерили при длине волны λ=425 нмв кювете с длинной поглощающего слоя 10-50 мм по отношению к холостому раствору, проведенного таким же образом с дистиллированной водой. По градуировочному графику нашли содержание железа общего [10]. 4 РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ Для определения железа общего и железа (III) в неокрашенных и слабоокрашенных поверхностных и очищенных сточных водах в диапазоне концентраций 0,4-9 мг/дм3 для Fe(III) и 0,2-9 мг/дм3 для Fe (общего) использовали фотометрический метод. Метод основан на том, что сульфосалициловая кислота или ее натриевая соль образуют с солями железа окрашенные комплексные соединения, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа (III) (красное окрашивание), а в слабощелочной среде с солями железа (III) и железа (II) (желтое окрашивание) [9]. Измерили оптическую плотность полученного (анализируемого) раствора при длине волны λ=425 нм в кювете с длинной поглощающего слоя 50 мм (т.к. окраска раствора более заметна) по отношению к холостому раствору, проведенного таким же образом с дистиллированной водой. Построение градуировочного графика (рис. 4) 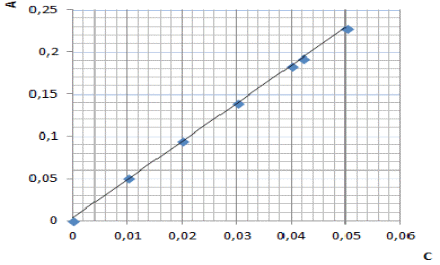 Рис 4 Градуировочный график для определения концентрации железа По градуировочному графику нашли концентрацию железа С=0,042 мг/дм3. Содержание железа рассчитали по формуле (6): X=C∙1000 / V (6) Fe (3+) = 0,04∙1000/80=0,525 мг/дм3, где Х - содержание железа, мг/дм3; С - концентрация железа, найденная по градуировочному графику, мг/дм3; V - объем, взятый для анализа, см3 [13]. Исходя из закона Бугера-Ламберта-Бера, основными оптимизируемыми параметрами фотометрического определения являются концентрационный диапазон, длина волны и толщина кюветы. Длину волны выбирали исходя из известного значения максимума поглощения окрашенного соединения и его близости к длине волны имеющегося светодиода на модуле «Фотоколориметр». Для оптимизации концентрационного диапазона определения загрязняющих веществ, соответствующего нормам ПДК, была выбрана кювета с l=5 см. При необходимости снижения или увеличения диапазона определяемых концентраций можно использовать кюветы толщиной 1 и 5 см [4]. Качество выполнения фотометрического анализа характеризуется показателями повторяемости, точности, внутрилабораторной прецизионности. Указанные метрологические характеристики методик были рассчитаны по ГОСТ РИСО 5725 [7]. В нормативных документах, устанавливающих требования к природным источникам питьевого водоснабжения, приводится предельно допустимая концентрация «железа общего», которая составляет 0,3 мг/дм3. Содержание железа Fe(3+)=0,525 мг/дм3, ПДК выше среднего. 5 ЗАКЛЮЧЕНИЕ Установлено, что фотометрические методы анализа применяются для определения многих элементов периодической системы, главным образом металлов и имеют большое значение в аналитическом контроле окружающей среды и решении экологических проблем [6]. Аппаратура, используемая в этих видах анализа, как правило, очень легка в эксплуатации, практически не требует особых навыков работы с ней, получаемые результаты достаточно хорошо воспроизводимы. В настоящее время, когда цена на новое оборудование, к сожалению, исчисляется в десятках тысяч (в лучшем случае рублей), на многих заводах, лабораториях, институтах используются фотоэлектроколориметры. Рассмотрен фотометрический метод определения массовой концентрации общего железа. Он основан на образовании с сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями Fe 3+ (красное окрашивание), а в слабощелочной среде с солями Fe 2+ и Fe 3+ (желтое окрашивание). Оптическую плотность окрашенного комплекса для железа общего измеряют при длине волны λ=425 нм, для Fe 3+, при длине волны λ=500 нм. В работе проведен анализ питьевой воды - фотометрическим методом. По результатам определили содержание железа Fe 3+= 0,525 мг/дм3, что не соответствует действующему законодательству, т. к. в соответствии с санитарными правилами и нормами СанПиН 2.1.4. 1074-01. Питьевая вода должна быть безопасна в эпидемическом и радиационном отношении, безвредна по химическому составу и должна иметь благоприятные органолептические свойства и ее предельно допустимая концентрация в воде не должна превышать 0,3 мг/дм3. 6 СПИСОК ЛИТЕРАТУРЫ Долгов, В.В. Фотометрия в лабораторной практике / В.В. Долгов, Е.Н. Ованесов, К.А. Щетникович М.: Высшая школа, 2004.-144 с. Бабко, А.К.Фотометрический анализ / А.К. Бабко, А.Т. Пилипенко М.: Химия, 1968.-190 с. Чакчир, Б.А. Фотометрические методы анализа. Методические указания / Б.А. Чакчир, Г.М. Алексеева, СПб.: Изд-во СПХФА, 2002. 44 с. Морозова, В.В. Апробация фотометрических методик определения некоторых загрязнителей окружающей среды / В.В. Морозова, Е.В. Ларионова // Вестник науки Сибири. - 2014. - № 1(11). - С. 17-24. Бабаев, А. Фотометрическое определение железа (III) и некоторых сопутствующих элементов В-дикетонами и их азометиновыми производными _ Дисс., канд. хим. наук. Баку, 1994. - 195 с. . ГОСТ Р (ИСО 5725-2002). Точность (правильность и прецизионность) методов и результатов измерений - Введ. 23.04.02. - М.: Госстандарт России, 2002. - С. 25-36 Лурье, Ю.Ю. Справочник по аналитической химии. М.: «Химия», 1979. 480 с. Шарло, Г. Методы аналитической химии. М.: «Химия»,1969. Ч.2. - 763 с. Поляк, Л.Я. Фотометрический анализ / Л.Я. Поляк // Вестник науки Сибири. - 2012. - № 5(8). - С. 198-208. Коренман, И.М. Фотометрический анализ. Методы определения органических веществ. М.: «Химия», 1970. 342 с. Булатов, М.И. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам/ М.И. Булатов, И.П. Калинкин -М.: «Химия» 1986 - 378 с. .Кеслер, И. Методы инфракрасной спектроскопии в химическом анализе. М.: «Мир», 1964. - 286 с. Марченко, 3. Фотометрическое определение элементов. М.: Мир, 1971. - с. 162. |
