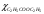контрольная. Курсовая работа по физической химии Электрохимия и химическая кинетика
 Скачать 123.75 Kb. Скачать 123.75 Kb.
|
Курсовая работапо физической химии«Электрохимия и химическая кинетика» Вариант № 9 Задача 1 Для реакции дана константа скорости омыления – К. Вычислить время, необходимое для омыления эфира, взятого в объёме V1 и концентрации С1 (н), если для омыления к указанному количеству эфира добавить: а) V1 (м3) С1 (н) раствора NaOH; б) V2 (м3) С2 (н) раствора NaOH; в) V3 (м3) С3 (н) раствора NaOH для случая, когда прореагируют 10, 20, 30, … N % эфира. Построить графики зависимостей скорости реакции (степени превращения) от времени. Сделать вывод о влиянии исходной концентрации щелочи на скорость реакции. 
Решение. а) Считая указанную реакцию, реакцией II порядка, выразим из соответствующего кинетического уравнения время: 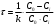 (1) (1)для случая, когда исходные концентрации обоих реагентов равны. Поскольку исходная концентрация эфира равна: С0=0,20, то для моментов времени, когда прореагирует 10, 20, 30 … 60% эфира, его концентрация будет составлять: 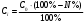 . .Тогда представим эти концентрации в виде таблицы:
Тогда соответственно время (рассчитанное по формуле 1), затрачиваемое на реакцию:
Степень превращения эфира равна: 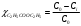 Получим ряд значений степени превращения в соответствующие моменты времени:
б) В этом случае исходные концентрация и объём эфира неодинаковы, поэтому необходимо воспользоваться кинетическим уравнением реакции II порядка для случая, когда вещества взяты в различных концентрациях: 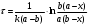 (2) (2)где a – исходная концентрация эфира; b – начальная концентрация щелочи; x – кол-во прореагировавшего эфира; Поскольку общий объём смеси равен V0=V1+V2=0.25+0.30=0.55, то начальные концентрации эфира и щелочи будут, соответственно, равны: 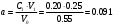 ; ;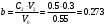 . .Тогда: 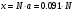 . .Для значений N=10…60% получим:
Подставляя полученные значения а,b и х в уравнение (2), получаем время, необходимое для того, чтобы прореагировало количество эфира, равное х:
Степень превращения эфира будет равна: 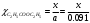 , , тогда:
в) Аналогично, поскольку исходные концентрации (и объёмы) реагентов не равны между собой, воспользуемся уравнением (2) для расчета времени реакции: 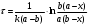 Общий объём реакционной смеси в этом случае равен: V0=V1+V3=0.25+0.20=0.45 Тогда: 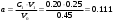 ; ;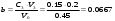 . .Тогда: 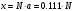 . .Для значений N=10…60% получим:
Время реакции (согласно формуле 2):
Степень превращения эфира будет равна: 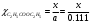 , тогда: , тогда:
По данным рассчитанных значений времени и степени превращения для каждого из трёх случаев, построим графики зависимости  : :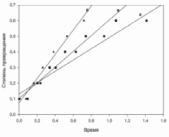 Как видно из графиков и приведенных выше расчетов, наименьшее время, требуемое на реакцию, достигается при добавлении щёлочи объёмом, большим исходного объёма эфира и с концентрацией, большей концентрации эфира. Если объём и концентрация щёлочи будут меньше объёма и концентрации эфира, то на реакцию потребуется большее количество времени, при той же степени превращения. Набольшее же время требуется в случае, когда исходные концентрации и объёмы щелочи и эфира одинаковы. Для построения графика зависимости скорости реакции от времени, найдём скорость реакции омыления эфира в соответствующие моменты времени, применяя кинетическое уравнение для реакции II порядка: 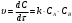 Получим значения скоростей: Для случая а):
Для случая б): 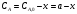 ; ;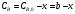 . .
Для случая в):
По данным сводных таблиц, построим графики зависимостей скорости реакции от времени. Как видно из анализа графиков и расчётов скорости реакции в каждом из трёх случаев, наибольшая скорость реакции достигается в случае равных объёмов и концентраций исходных реагентов, меньшая скорость – в случае, когда объём и концентрация у щелочи, больше чем у эфира, наименьшая скорость – при условии, что щелочи добавляется меньше, чем эфира, и её концентрация меньше, чем у эфира. 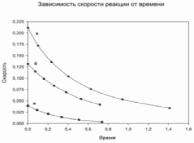 Задача 2 По значениям констант скоростей К1 и К2 при двух температурах Т1 и Т2 определить: Энергию активации указанной реакции; Константу скорости реакции при температуре Т3; Температурный коэффициент скорости; определить подчинённость правилу Вант-Гоффа; Израсходованное количество вещества за время  , если исходная концентрация равна С0; , если исходная концентрация равна С0;Период полураспада. Принять, что порядок реакции и молекулярность совпадают. 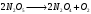 К1=0,00203; К2=0,000475; Т1=298 К; Т2=288 К; Т3=338 К; 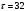 ; ;С0=0,93 моль/л. Решение. Приняв, что молекулярность реакции и ее порядок совпадают, будем считать, что данная реакция есть реакция II порядка, поскольку в ее элементарном акте участвуют две молекулы. 1. Согласно уравнению Аррениуса: 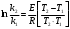 , выразив откуда энергию активации, получим: , выразив откуда энергию активации, получим: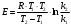 , подставляя заданные значения констант и температур, найдём: , подставляя заданные значения констант и температур, найдём: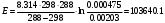 Дж/моль; Дж/моль;2. Выразим из уравнения Аррениуса константу скорости реакции: 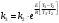 , получим: , получим: 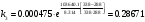 . .3. Согласно уравнению Вант-Гоффа: 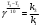 , откуда температурный коэффициент равен: , откуда температурный коэффициент равен: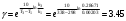 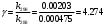 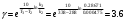 Как видно, температурный коэффициент изменяется и не принадлежит интервалу от 2 до 4, из этого можно сделать вывод о несоответствии реакции правилу Вант-Гоффа. 4. Применяя кинетическое уравнение реакции II порядка, можно найти количество вещества, которое было израсходовано за время  : :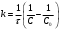 , откуда: , откуда: 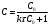 - текущая концентрация эфира. - текущая концентрация эфира.Тогда найдем, сколько вещества прореагировало: при температуре 288 К: 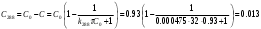 ; ;при температуре 298 К: 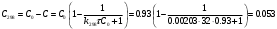 ; ;при температуре 338 К: 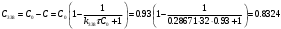 . .5. Для нахождения периода полураспада воспользуемся следующей формулой (принимая порядок данной реакции – второй): 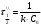 Тогда, пользуясь этой формулой, найдём период полураспада при каждой из трёх температур: 288, 298, 338 К, подставив соответствующие константы скорости: при температуре 288 К: 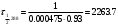 ; ;при температуре 298 К: 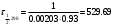 ; ;при температуре 338 К: 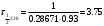 . .Задача 3 Используя данные о свойствах растворов вещества А в воде: а) построить графики зависимости удельной и эквивалентной электрических проводимостей растворов вещества А от разведения V; б) проверить, подчиняются ли растворы вещества А закону разведения Ост-вальда; Вещество А: NH4OH. Зависимость сопротивления r раствора вещества А от концентрации с при 298 К:
Решение. а) Удельная электрическая проводимость, по определению, равна: æ 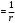 , ,Разведение (разбавление) есть величина, обратная концентрации, т.е.: 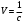 . .Используя эти зависимости, получим ряд значений удельной электрической проводимости и разведения:
Полученные значения можно использовать для построения графика зависимости удельной электрической проводимости от разведения:  Зная зависимость эквивалентной эл. проводимости от разведения и удельной проводимости, можно рассчитать значения λV и построить график зависимости λV=f(V): 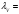 æ æ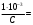 1·10-3·æV 1·10-3·æV
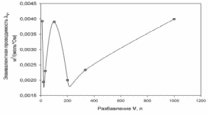 б) Проверим, подчиняются ли растворы вещества А закону разведения Оствальда: 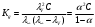 , ,где степень диссоциации 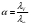 ; причем значение ; причем значение 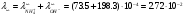 м2/Ом·моль – из справочника. м2/Ом·моль – из справочника.Тогда:
Сравнивая полученные значения константы диссоциации с ее табличным значением, равным 1,77·10-5, приходим к выводу, что растворы NH4OH практически не подчиняются закону разведения Оствальда. Задача 4 Для реакции, протекающей обратимо в гальваническом элементе, дано уравнение зависимости ЭДС от температуры. При заданной температуре вычислить ЭДС Е, изменение энергии Гиббса ΔG, изменение энтальпии ΔН, изменение энтропии ΔS, изменение энергии Гельмгольца ΔА и теплоту Q, выделяющуюся или поглощающуюся в этом процессе. Расчет провести для 1 моль реагирующего вещества. Т=273 К; 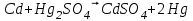 ; ;Зависимость ЭДС от Т: 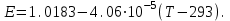 Решение. Имея зависимость E=f(T), можно рассчитать ЭДС при указанной температуре, подставив ее в это уравнение: 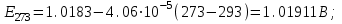 Изменение энтропии связано с температурой следующим соотношением: 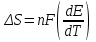 , ,найдем производную зависимости E=f(T) по температуре (температурный коэффициент ЭДС гальванического элемента): 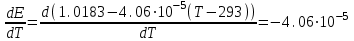 . .Очевидно, значение ΔS не зависит от температуры и определяется лишь числом передаваемых электронов: 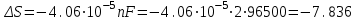 Дж/К. Дж/К.Изменение энергии Гиббса равно: 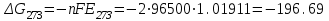 кДж. кДж.Найдём изменение энтальпии по формуле: 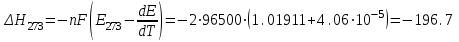 кДж. кДж.Поскольку изменение энергии Гельмгольца равно 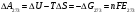 , , то 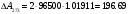 кДж/моль. кДж/моль.Найдём теплоту, которая выделяется (или поглощается) при работе гальванического элемента: 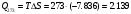 кДж. кДж.Как видно из вышеприведённых расчетов, при работе гальванического элемента, выделяется 2,139 кДж (в расчёте на 1 моль) теплоты (экзотермическая реакция), на что указывает и знак температурного коэффициента ЭДС. Таким образом, в адиабатических условиях, элемент работает с нагреванием. |