Курсовой проект производство серной кислоты вариант 2 Студент Горбунова Анна Группа мт43 Преподаватель Чабан Н. Г
 Скачать 227.91 Kb. Скачать 227.91 Kb.
|
Контактное окисление диоксида серы.Реакция окисления диоксида серы характеризуется очень высоким значением энергии активации и поэтому практическое ее осуществление возможно лишь в присутствии катализатора. В промышленности основным катализатором окисления SO2, является катализатор на основе пентоксида ванадия V2О5. Каталитическую активность в этой реакции проявляют и другие соединения, прежде всего платина. Однако платиновые катализаторы чрезвычайно чувствительны к следам мышьяка, селена, хлора и других примесей и поэтому постепенно были вытеснены ванадиевыми катализаторами. Каталитическую активность проявляет также оксид железа (III) Fe2О3, однако лишь в области высоких температур. Каталитической активностью Fe2О3, входящего в состав огарка, можно объяснить наличие в обжиговом газе небольших количеств триоксида серы. Реакция окисления диоксида серы — обратимая экзотермическая. При 500°С тепловой эффект реакции ΔН =-94,23 кДж/моль. Константа равновесия 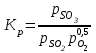 может быть рассчитана по уравнению 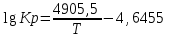 Равновесная степень превращения SO2 выражается формулой 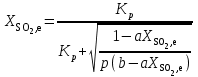 где p – общее давление; a и b – молярные доли SO2 и О2 в исходной реакционной смеси. Зависимости равновесной степени превращения SO2 от температуры при разных давлениях построены для исходной реакционной смеси, содержащей 7% SO2, 11% O2, 82% N2. 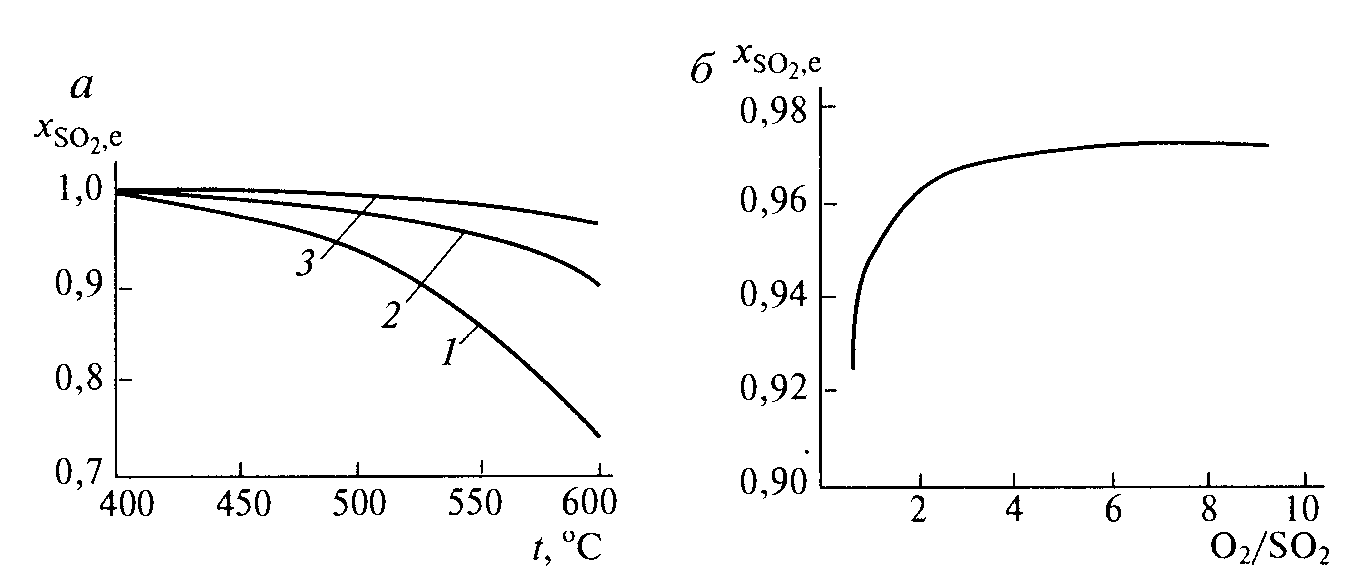 Рис. 3. Зависимости равновесной степени превращения SO2 от температуры при давлении 0,1 МПа (1), 1 МПа (2), 10 МПа (3) (а), от молярного отношения О2/SO2 при температуре 475 оС и давлении 0,1 МПа (б). Скорость реакции и вид кинетического уравнения зависят от типа применяемого катализатора. В промышленности это в основном ванадиевые контактные массы, в составе которых примерно 8% V2О5, нанесенного на пористый носитель. Скорость каталитического окисления диоксида серы на ванадиевом катализаторе описывается уравнением 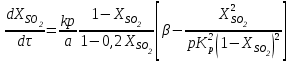 где ХSО2 — степень превращения диоксида серы; τ — время; k — константа скорости прямой реакции; р — давление; β = (b - 0,5аХSО2)/(1 — 0,5аХSО2); Кр — константа равновесия. Для упрощенных расчетов можно пользоваться уравнением Борескова 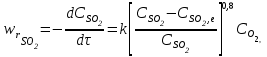 Из уравнений следует, что скорость реакции зависит от степени приближения к равновесию и как функция температуры проходит через максимум (с ростом температуры растет константа скорости прямой реакции и уменьшаются константа равновесия и равновесная степень превращения). Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке. Для осуществления реакции с высокой скоростью кислород берут почти в трехкратном избытке по отношению к стехиометрическому количеству. Для этого более концентрированный обжиговый газ (14—15% SО2) разбавляют воздухом перед стадией контактного окисления. Так как реакция окисления SО2 относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. На выбор температурного режима дополнительно накладываются два ограничения, связанные со свойствами катализатора. Нижней предельной является температура зажигания ванадиевых катализаторов, составляющая в зависимости от конкретного вида катализатора и состава газа 400—440°С. Верхняя предельная температура составляет 600-650°С. Выше этих температур происходит перестройка структуры катализатора и он теряет свою активность. Если вести процесс при постоянной температуре 600оС, то начальная скорость реакции будет высокой, но, в соответствии с состоянием равновесия, процесс закончится при достижении значительно меньшей степени превращения, чем при 400оС. Для обеспечения и высокой интенсивности процесса, и высокого выхода необходимо проводить окисление при переменных условиях. На рис. 4 приведен график зависимости равновесного и практического выхода от температуры при различных временах контактирования. С увеличением времени контактирования максимум на кривых смещается в сторону более низких температур. Кривую, соединяющую максимумы на различных кривых, называют линией оптимальных температур. 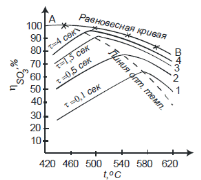 Рис. 4. Зависимость выхода продукта от температуры при различных временах контактирования. При проведении процесса по ЛОТ окисление диоксида серы протекает с максимально возхможными скоростями в каждый момент. Понижение температуры к концу процесса с 600оС до 400оС позволяет получить высокий выход продукта при достаточной производительности процесса. Схема организации этого процесса приведена на рис. 5. 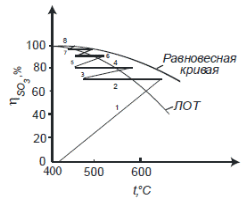 Рис. 5. Диаграмма пятиступенчатого процесса контактирования с промежуточным теплообменом Чаще всего в промышленности используют полочные контактные аппараты с наружным теплообменом. Схема теплообмена предполагает максимальное использование теплоты реакции для подогрева исходного газа и одновременное охлаждение газа между полками. Одна из важнейших задач, стоящих перед сернокислотной промышленностью,— увеличение степени превращения диоксида серы и снижение его выбросов в атмосферу. Эта задача может быть решена несколькими методами. Один из наиболее рациональных методов, повсеместно применяемый при производстве серной кислоты,— метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакционную смесь, в которой степень превращения SО2 составляет 90—95%, охлаждают и направляют в промежуточный абсорбер для выделения SО3. В оставшемся реакционном газе отношение О2:SО2 существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ снова подают в контактный аппарат, где на одном-двух слоях катализатора достигают 95%-ной степени превращения оставшегося SО2. Суммарная степень превращения SO2, составляет в таком процессе 99,5—99,8%. |
