ЛР № 1 Измерение электродвижущих сил химических и концентрирован. Лабораторная работа 1 Измерение электродвижущих сил химических и концентрированных элементов. Приборы и реактивы
 Скачать 37.13 Kb. Скачать 37.13 Kb.
|
|
Лабораторная работа № 1 Измерение электродвижущих сил химических и концентрированных элементов. Приборы и реактивы: Учебно-лабораторный комплекс «Химия» в следующей комплектации: центральный контроллер, модуль «Электрохимия». Растворы ZnSO4(0,1M), CuSO4(0,01; 0,1и 1М), дистиллированная вода. Хлорсеребрянный электрод. Лабораторная посуда. Измерение ЭДС гальванического элемента Даниэля-Якоби. Медную и цинковую пластин, используемые в качестве электродов, очищаем до блеска. Составляем гальванический элемент Даниэля-Якоби. Для этого 3 стакана заполняем растворами ZnSO4(0,1M) , KCl(нас) , CuSO4(0,1М) . В раствор ZnSO4(0,1M) опустим цинковую пластину, а в CuSO4(0,1М) медную. И растворы в стаканах соединяем электролитическими ключами. Измеряем ЭДС. Результаты:
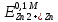 = = 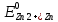 + +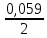 *lg( *lg(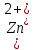 * *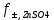 ) = -0,764+ ) = -0,764+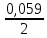 * lg( * lg(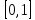 * *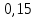 ) = - 0,8178 В ) = - 0,8178 В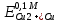 = = 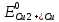 + +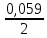 *lg( *lg(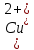 * *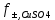 ) = 0,345 + ) = 0,345 +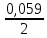 * lg( * lg(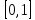 * *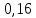 ) = 0,2920 В ) = 0,2920 В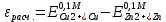 = 0,2920-(-0,8178) = 1,1098В = 0,2920-(-0,8178) = 1,1098ВD= 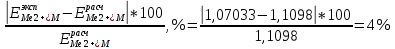 Измерение потенциалов отдельных электродов. Составляем гальваническую цепь: (-)Ag,AgCl|KCl(нас)|CuSO4(0,1М)|Cu(+) (-)Zn| ZnSO4(0,1M)| KCl(нас)| Ag,AgCl (+) Соблюдая полярность, подключаем электроды гальванического элемента к соответствующим каналам модуля и измеряем ЭДС. Рассчитываем потенциалы цинкового и медного электродов. Рассчитываем относительную погрешность измерений(D).
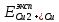 = = 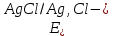 + + 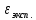 = 0,200 +0.04543 = 0.24543 B = 0,200 +0.04543 = 0.24543 B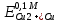 = = 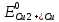 + +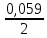 *lg( *lg(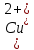 * *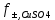 ) = 0,345 + ) = 0,345 +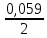 * lg( * lg(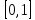 * *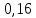 ) = 0,2920 В ) = 0,2920 ВD= 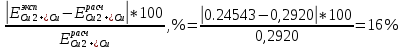 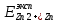 = = 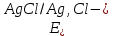 - - 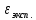 = 0,200 – 1,02592 = -0,82592 B = 0,200 – 1,02592 = -0,82592 B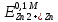 = = 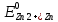 + +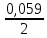 *lg( *lg(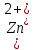 * *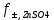 ) = -0,764+ ) = -0,764+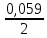 * lg( * lg(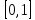 * *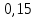 ) = - 0,8178 В ) = - 0,8178 ВD= 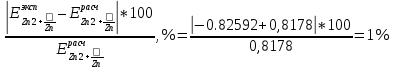 Измерение ЭДС концентрационных элементов. Составляем гальваническую цепь: (-)Cu|CuSO4(0,01М)| KCl(нас)|CuSO4(0,1М)|Cu(+) (-)Cu|CuSO4(0,1М)| KCl(нас)|CuSO4(1М)|Cu(+) (-)Cu|CuSO4(x М)| KCl(нас)|CuSO4(1М)|Cu(+) Соблюдая полярность, подключаем электроды гальванического элемента к соответствующим каналам модуля и измеряем ЭДС. Рассчитываем потенциалы медных электродов в растворах сульфата меди с концентрациями 0,01М и 1 М.
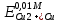 = = 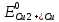 + +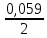 *lg( *lg(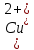 * *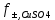 ) = 0,345 + ) = 0,345 +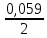 * lg( * lg(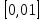 * *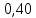 ) = 0,27426 В ) = 0,27426 В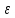 расч = расч = 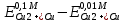 = 0,2920 – 0,27426 = 0,01774 B = 0,2920 – 0,27426 = 0,01774 B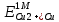 = = 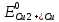 + +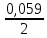 *lg( *lg(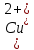 * *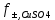 ) = 0,345 + ) = 0,345 +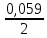 * lg( * lg( * *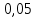 ) =0,30662 В ) =0,30662 В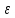 расч = расч = 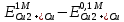 = 0,30662 - 0,2920 = 0,01462 B = 0,30662 - 0,2920 = 0,01462 B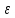 эксп = эксп = 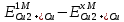 = = 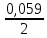 * lg( * lg(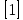 * *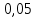 ) - ) - 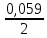 * lg( * lg(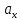 ) ) 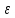 эксп = - 0,03838 – 0,0295 lg( эксп = - 0,03838 – 0,0295 lg(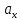 ) )0,01441 = - 0,03838 – 0,0295 lg( 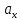 ) )lg( 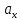 ) = -1,7895 ) = -1,7895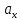 = = 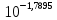 = 0,01624 = 0,01624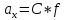
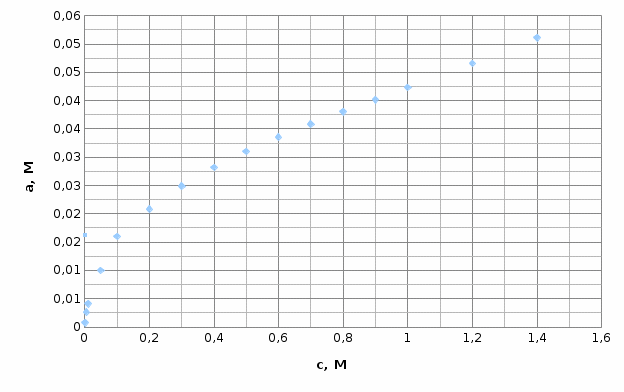 Cx = 0,1 f = 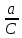 = = 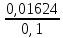 = 0,1624 = 0,1624 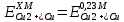 = = 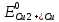 + +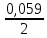 *lg( *lg(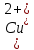 * *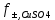 ) = 0,345 + ) = 0,345 +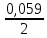 * lg( * lg( *0,164) = 0,2394 В *0,164) = 0,2394 В расч = расч = 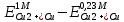 = 0,30662 - 0,2394 = 0,067 B = 0,30662 - 0,2394 = 0,067 B | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

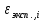 , В
, В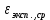 , В
, В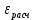 , В
, В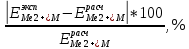
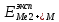 , В
, В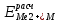 , В
, В