Три лаб.работы. Лабораторная работа 1 Измерение тепловых эффектов химических реакций
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
|
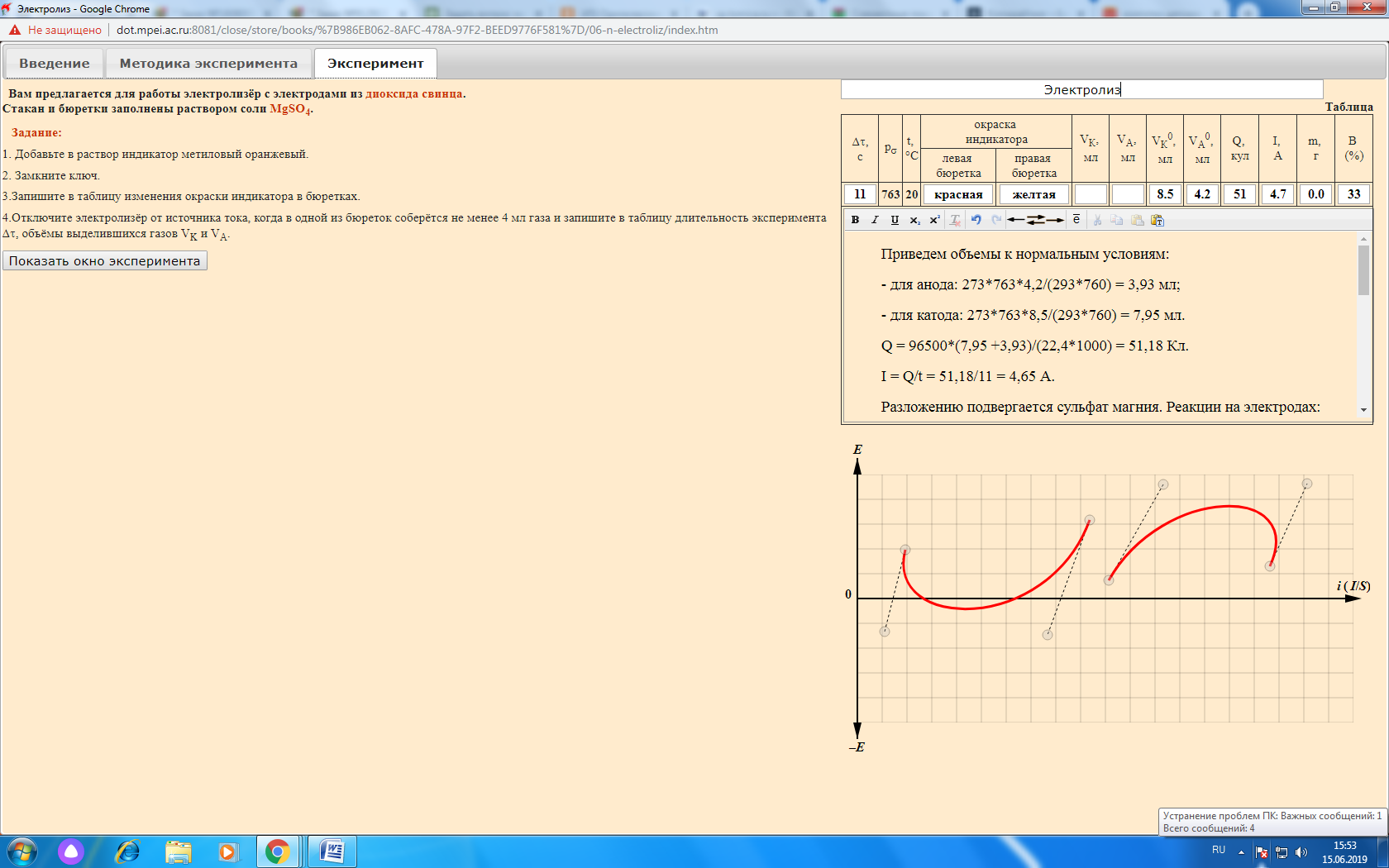
Лабораторная работа № 1 «Измерение тепловых эффектов химических реакций» Цель работы – выполнение калориметрических измерений и термодинамических расчётов, связанных с энергетикой химических реакций. Определим теплоту нейтрализации сильной кислоты сильным основанием. Данные эксперимента сведем в таблицу: 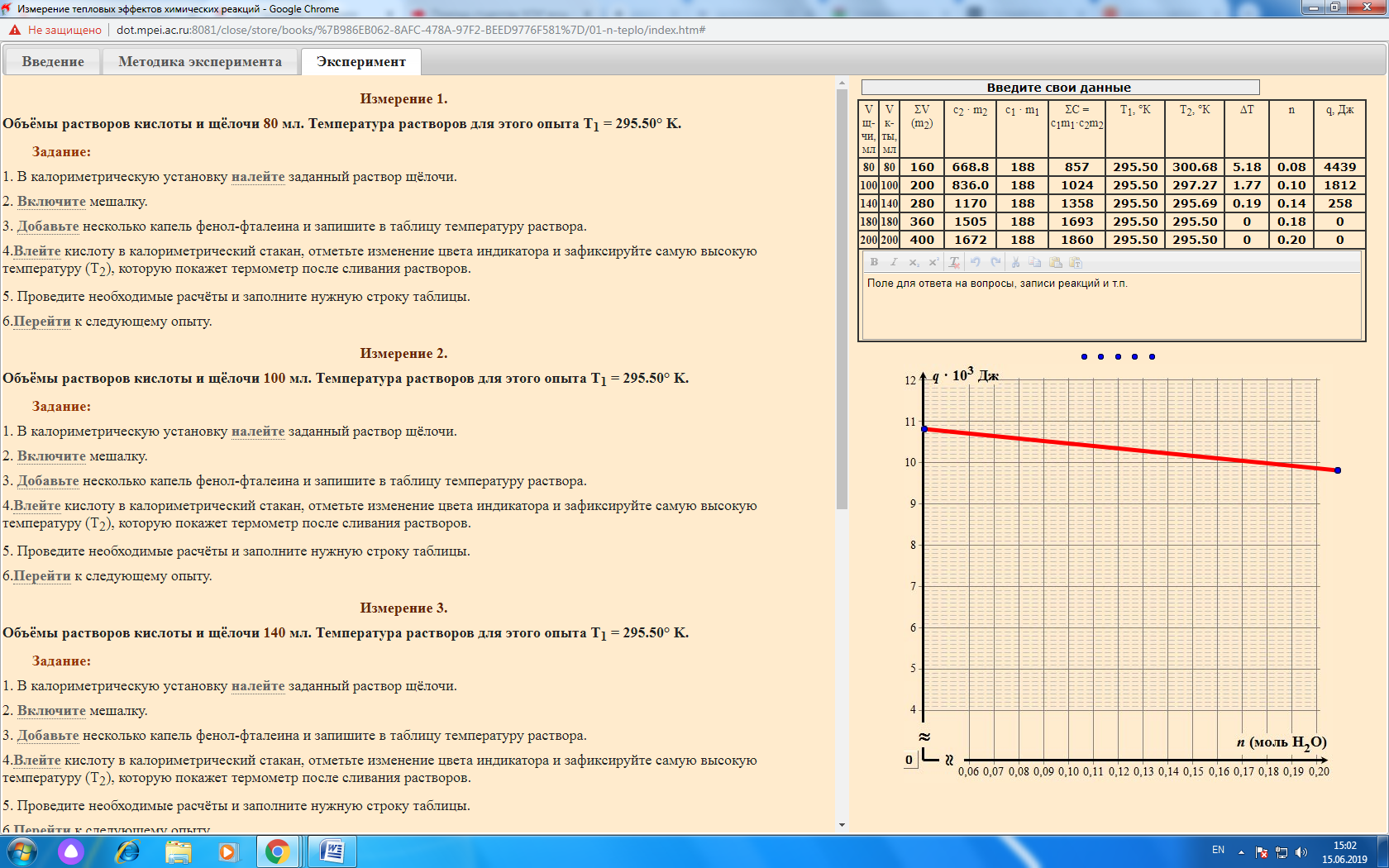 График зависимости q = f(n):  Уравнение реакции нейтрализации: KOH + HCl = KCl + H2O Изменение окраски индикатора с цветной (малиновой) на бесцветную указывает на точку эквивалентности. Теплота нейтрализации практическая: Qпр = q/n = (-4439/0,08)/1000 = -55,5 кДж. Теплота нейтрализации теоретическая: Qтеор. = -55,9 кДж. Абсолютная ошибка опыта: |(-55,9) - (-55,5)| = |-0,4| = 0,4. Относительная ошибка опыта: (0,4/ |-55,9|) *100 = 0,7 %. Лабораторная работа № 2 «Водородный показатель среды рН» Цель работы – ознакомление с методом pH-метрии, проведение расчётов pH водных растворов сильных и слабых кислот и оснований, определение концентрации растворов на основе измеренных значений pH. Выводы: измеренные значения хорошо согласуются с рассчитанными. С ростом концентрации электролита рН уменьшается. Ход зависимостей для сильного и слабого электролитов не различается. Степень диссоциации уменьшается с ростом концентрации слабого электролита. Существенное различие между величинами рН растворов сильных и слабых электролитов одинаковой концентрации объясняется за счет диссоциации (сильные электролиты в отличие от слабых диссоциируют нацело). Отчет по лабораторной работе № 2 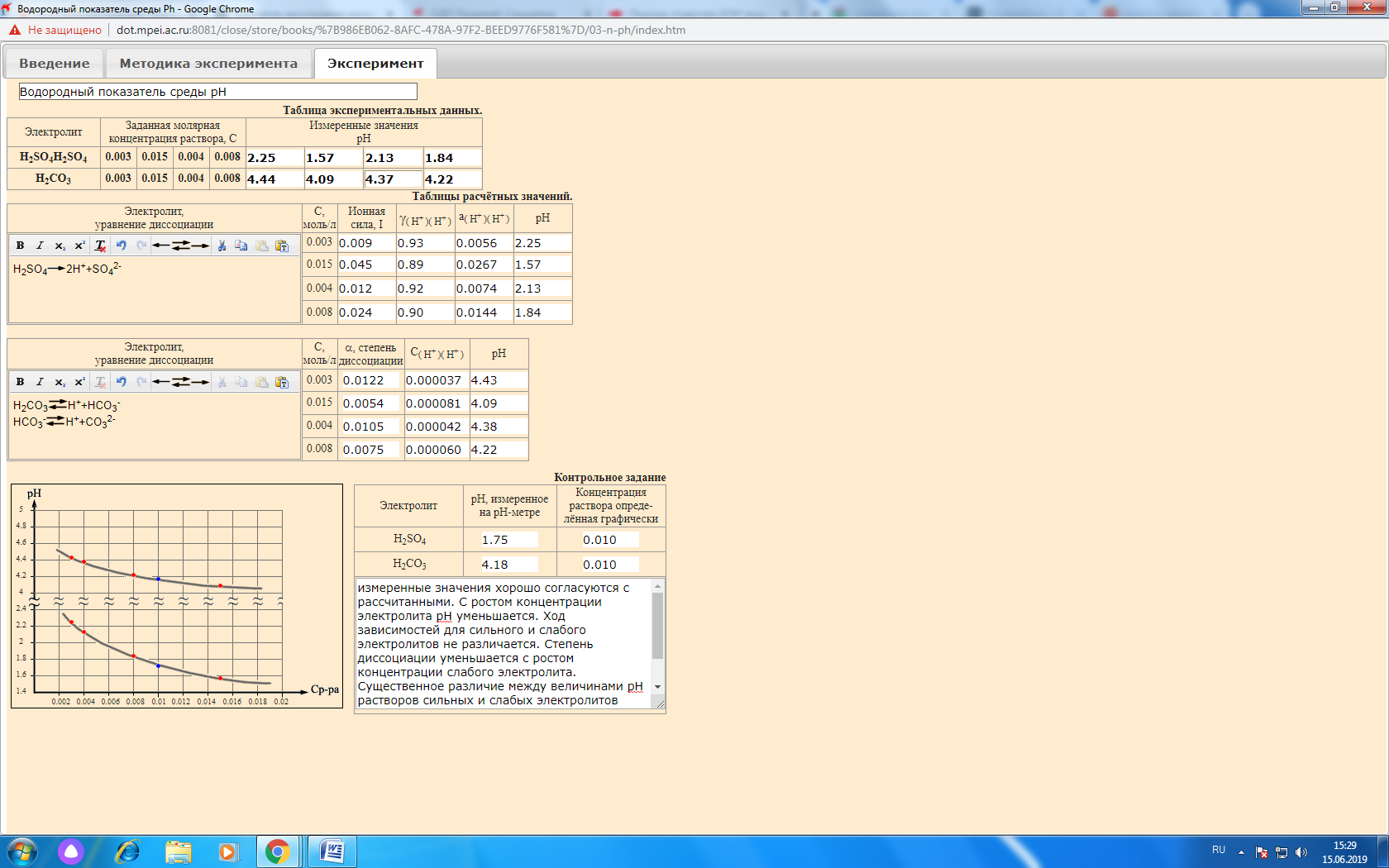 Лабораторная работа № 3 «Электролиз» Цель работы – ознакомление с процессами, протекающими на нерастворимых электродах при электролизе водного раствора соли и с расчётами необходимого количества электричества и выхода вещества по току. Приведем объемы к нормальным условиям: - для анода: 273*763*4,2/(293*760) = 3,93 мл; - для катода: 273*763*8,5/(293*760) = 7,95 мл. Q = 96500*(7,95 +3,93)/(22,4*1000) = 51,18 Кл. I = Q/t = 51,18/11 = 4,65 А. Разложению подвергается сульфат магния. Реакции на электродах: - на аноде: 2H2O -4е = O2 + 4H+ (Е = 1,229 В) - на катоде: 2H2O +2е = H2 + 2OH- (Е = -0,413 В) Продукты электролиза - кислород, водород, гидроксид магния и серная кислота. Окраска индикатора изменилась в связи с изменением нейтральной реакции среды на кислую (красная окраска анода) и щелочную (желтая окраска катода). По закону Фарадея масса кислорода, выделившегося на аноде: m1 = Э*I*t/F = 8*4,65*11/96500 = 0,0042 г. Выход по току кислорода составит: B = 3,93*100/(3,93+7,95) = 33,1 %. Приблизительный ход поляризационных кривых анода и катода показан ниже на графике. Одним из путей повышения производительности электролизеров является увеличение плотности тока. |