Лабораторная работа №2. Лабораторная работа 2 Определение содержания никеля Работа проводится в три этапа
 Скачать 85.31 Kb. Скачать 85.31 Kb.
|
Лабораторная работа №2Определение содержания никеляРабота проводится в три этапа:Проведение фотоколориметрической реакции. Измерение оптической плотности раствора. Расчѐт концентрации никеля в анализируемой пробе сплава. Проведение фотоколориметрической реакции. Никель в чѐрных сплавах находится в виде компонента твѐрдого раствора. Чтобы определить концентрацию никеля методом фотоколориметрии, необходимо анализируемую пробу растворить и получить окрашенное соединение. При растворении в азотной кислоте никель переходит в раствор 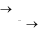  3 Ni + 4HNO3 Ni(NO3)2 + 2NO2 + 2H2O; Ni + 4H+ + 2NО Ni2+ + 2NO2 + 2H2O. Ионы никеля образуют с диметилглиоксимом в присутствии сильных окислителей растворимый комплекс красного цвета.  NiCl2 + 2 +2NH4OH→ CH3 C=N OH NiCl2 + 2 +2NH4OH→ CH3 C=N OH Н Н  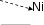  CH3 C=N O О N=C CH3 CH3 C=N O О N=C CH3 CH3 C=N O О N=C CH3 Н CH3 C=N O О N=C CH3 Н+ 2NH4Cl + 2Н2О. Фотоколориметрическую реакцию проводят в щелочной среде и для предупреждения осаждения щѐлочью гидроксидов железа, марганца, алюминия и других металлов, входящих в состав пробы, прибавляют комплексообразователь – сегнетову соль, в присутствии которой перечисленные компоненты не осаждаются. Ход анализа. Навеску стали 0,1 г помещаем в коническую колбу на 100 мл и растворяем при нагревании в 10 мл азотной кислоты (1:3), затем разбавляем небольшим количеством воды (10 мл). Полученный раствор переводим в мерную колбу на 100 мл, тщательно ополаскивая колбочку, в которой велось растворение, небольшими порциями дистиллированной воды (4-5 раз). Затем доводим содержимое мерной колбы водой до метки. Полученный раствор в мерной колбе тщательно перемешиваем. Подготовка к колориметрированию. Подсоединяем фотоколориметр к сети 220 В, открываем крышку кюветного отделения 4 (рис. 2) и включаем тумблер «Сеть» (загорается сигнальная лампа). Нажимаем клавишу «Пуск» – на цифровом табло появляется мигающая запятая и горит индикатор «Р». Прогреваем прибор в течение 15 минут при открытой крышке кюветного отделения и 5 минут при закрытой крышке. А пока готовим растворы. Для колориметрирования одновременно готовим два раствора. Один - рабочий, другой – холостой (раствор сравнения). Из мерной колбы на 100 мл отбираем пипеткой по 5 мл в две мерные колбы на 50 мл. В каждую колбу прибавляем по 10 мл 20 % раствора сегнетовой соли, 10 мл 5 % раствора щѐлочи и хорошо взбалтываем. При этом раствор должен обесцветиться. Затем прибавляем 10 мл 3 % раствора персульфата аммония (NH4)2S2O8 в качестве окислителя и взбалтываем. В одну из колб прибавляем 10 мл щелочного раствора диметилглиоксима (это будет рабочий раствор). Обе колбы доводим до метки 5 % раствором щѐлочи и тщательно перемешиваем. Интенсивность окраски полученного комплекса пропорциональна содержанию никеля в сплаве. Чтобы окрашенное комплексное соединение сформировалось, необходимо соблюдать условия: температуру реакции; среду раствора; соотношение компонентов и порядок их приливания. Окрашенный комплекс неустойчив, имеет период формирования, короткий период стабильности и период разрушения. Измерение оптической плотности раствора следует проводить в период стабильности комплекса (через 7 минут после сливания всех реагентов). Измерение оптической плотности раствора. Оптическую плотность окрашенного раствора (выдержанного 7 минут) измеряют на (предварительно прогретом 20 минут) приборе фотоколориметре. Открываем крышку кюветного отделения. В него устанавливаем кюветы (на 30 мл) с рабочим раствором ближе к себе и холостым раствором сравнения дальше от себя. Устанавливаем светофильтр сине-зеленый и длину волны λ=490 нм. Рычаг устанавливаем в крайнее левое положение. При этом в световой пучок вводится кювета с холостым раствором сравнения. При открытой крышке кюветного отделения нажимаем «Ш(0)». На цифровом табло справа от мигающей запятой высвечивается значение nо, а слева – символ «0». Закрываем крышку кюветного отделения, нажимаем «К(1)» – появится символ «1». Рычаг устанавливаем в крайнее правое положение. В световой пучок вводится кювета с рабочим раствором. Нажимаем клавишу «Д(5)». На цифровом табло слева от мигающей запятой появляется символ «5», означающий, что произошло измерение оптической плотности. Отсчѐт на цифровом табло справа от мигающей запятой соответствует оптической плотности исследуемого раствора. Для сброса показаний нужно нажать клавишу «Пуск», появится мигающая запятая. Рычаг установить в крайнее левое положение, открыть крышку кюветного отделения и в той же последовательности повторить измерение 2-3 раза. Расчѐт концентрации никеля в анализируемой пробе.Снимаем показания оптической плотности из 3-х измерений и рассчитываем среднее значение Д. Д1 = 0,185 С1 = 0,188 % Д2 = 0,190 С2 = 0,194 % Д3 = 0,198 С3 = 0,202 % Дср = 0,191 Сср = 0,195 % Сх = Сср = 0,195 % Истинное значение содержания никеля в исследуемой пробе, озвученное преподавателем, равно Сист = 0,345 % Относительную ошибку рассчитывают по формуле: 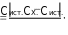 % ошибки 100%, % ошибки 100%, % ошибки = 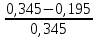  100% = 43,48 % 100% = 43,48 %Вывод: В ходе работы мы определили процентное содержание никеля в анализируемой пробе Сх = 0,195 %. По условиям данной работы ошибка метода составляет 3-5%, у нас она составила 43,48%. Значит, в ходе выполнения работы были допущены ошибки и работа выполнена с нарушением каких-либо условий. Необходимо повторить опыт с самого начала. Возможные ошибки: Не выдержана температура реакции Не соблюдена среда раствора Не соблюдено соотношение компонентов и порядок их приливания Грязная химическая посуда Не прогретый ККК-2МП Не выдержано положенное время отстаивания раствора (пропущен период стабильности, замер оптической плотности провели в период разрушения). Не свежеприготовленные реактивы и т.д.  |
