Лабораторная работа 2 По дисциплине химия, Часть 1 (наименование учебной дисциплины согласно учебному плану)
 Скачать 58.14 Kb. Скачать 58.14 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»  Кафедра общей химии Лабораторная работа № 2
(группа) (подпись) (Ф.И.О) ОЦЕНКА: Дата:
Санкт Петербург 2022 Цель работы - ознакомиться с практическими выводами теории электролитов, с реакциями в растворах электролитов и научится составлять их уравнения. Общие теоретические сведения Электролитическая диссоциация – это процесс распада молекул электролитов на ионы под действием полярных молекул растворителя. Степень диссоциации – способность электрона распадаться на ионы характеризуемые степенью диссоциации 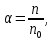 где 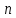 – число продиссоциированых молей – число продиссоциированых молей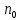 - исходное число молей электролита. - исходное число молей электролита.Процесс диссоциации обратим, и приводит к равновесию между недиссоциированными молекулами и ионами, и, следовательно, подчиняется закону действующих масс. Константа диссоциации – это постоянное отношение произведения концентраций конечных и исходных веществ при постоянной температуре. 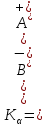 где 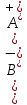 – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг – концентрации ионов и молекул электролита в растворе, моль/л или моль/кгВсе электролиты по степени и величине константы делятся на сильные (диссоциируют в растворе полностью) и слабые (частично диссоциируют в растворе). К сильным электролитам относят: = Кислоты: азотную HNO3, серную H2SO4, соляную HCl, бромисто- и йодистоводородные HBr и HI, хлорную HClO4. = Гидроксиды щелочных металлов, стронция и бария. = Соли. Остальные электролиты являются слабыми. Мало диссоциированными соединениями являются также комплексные ионы в растворе. Константы их диссоциации даны в справочниках. Правила написания молекулярно-ионных уравнений реакций в растворах электролитов. = Сильные электролиты записывают в диссоциированной форме, в виде отдельных составляющих их ионов. = Слабые электролиты, сложные ионы, в том числе и комплексные, а также малорастворимые соединения и газы записывают в молекулярной, недиссоциированной форме. Порядок выполнения работы Опыт 1. Образование малорастворимых оснований. В одну пробирку налить 3-5 капель раствора соли железа (III), в другую – столько же раствора соли меди (II), в третью – раствора соли никеля (II). В каждую пробирку добавить по несколько капель щелочи до выпадения осадков. Осадки сохранить до следующего опыта. Опыт 2. Растворение малорастворимых оснований. К полученным в предыдущем опыте осадкам добавить по несколько капель раствора соляной кислоты концентрацией 15% до их полного растворения. Опыт 3. Образование малорастворимых солей. А. в две пробирки налить по 3-5 капель раствора нитрата свинца (II) и прибавить в одну пробирку несколько капель йодида калия, в другую – хлорида бария. Опыт 4. Изучение свойств амфотерных гидроксидов В. в две пробирки внести по пять капель раствора сульфата хрома (III) и несколько капель раствора гидроксида натрия до образования осадка гидроксида хрома (III). Растворить полученные осадки в одной пробирке в растворе соляной кислоты, в другой – в избытке раствора гидроксида натрия. Опыт 6. Образование комплексов. В пробирку налить 5−7 капель раствора сульфата меди (II), затем по каплям добавить раствор аммиака до растворения образующегося осадка основной соли меди. Обратите внимание на окраску растворимого амминокомплекса меди. Опыт 1 1. FeCl3 + 3NaOH → 3NaCl + Fe(OH)3 ↓ - образовался осадок ржавого цвета 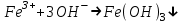 2. CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2 ↓ - образовался синий осадок 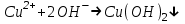 3. NiSO4 + 2NaOH → Na2SO4 + Ni(OH)2  - образовался осадок светло-зелёного цвета - образовался осадок светло-зелёного цвета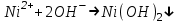 Данные осадки гидроксидов металлов относятся к классу труднорастворимых оснований. В избытке щелочи они растворяться не будут. Они относятся к слабым электролитам. Опыт 2 1. Fe(OH)3 + 3HCl → FeCl3 + 3H2O - осадок растворился, раствор желтого цвета 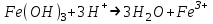 2. Cu(OH)2 + 2HCl → CuCl2 + 2H2O - раствор светло-голубого цвета  3. Ni(OH)2 + 2HCl → NiCl2 + 2H2O - раствор бледно-зелёного цвета 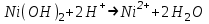 При растворении гидроксидов металлов в кислоте образуется соль и вода. При этой реакции образуется мало диссоциированное соединение – вода. Вывод: реакция протекает, и вещества растворяются в кислоте из-за образования более слабого электролита (воды). Опыт 3 (А) 1. Pb(NO3)2 + 2KI → 2KNO3 + PbI2↓ – образование ярко-желтого осадка в виде хлопьев 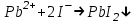  2. Pb(NO3)2 + BaCl2 → Ba(NO3)2 + PbCl2 ↓– выпадение осадка молочного цвета 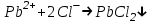 Осадки с ионами хлора и йода образует ион свинца. Окраску иодиду свинца придает ион йода. Наименее растворимым является хлорид свинца (PbCl2). Вывод: реакции протекают из-за образования труднорастворимых в воде веществ Опыт 4 (В) 1. Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓ + 3Na2SO4 – белый осадок 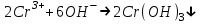 2. Cr(OH)3 + 3HCl → CrCl3 + 3H2O – осадок растворился, раствор стал зелёным 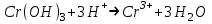 3. Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] – осадок растворился, раствор тёмно-зелёный 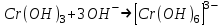 Вывод: гидроксид хрома является типичным амфотерным основанием, так как реагирует с раствором кислоты и с раствором щелочи. Опыт 6 1. 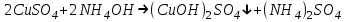 – осадок тёмно-синего цвета – осадок тёмно-синего цвета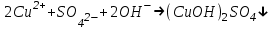 2. 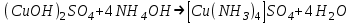 - раствор синего цвета - раствор синего цвета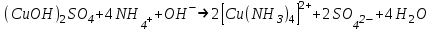 Вывод: в ходе работы ознакомились с практическими выводами теории электролитов и научились составлять их уравнения. |
