Лабораторная работа №2 атом водорода. Лабораторная работа 2 спектр излучения атомарного водорода
 Скачать 60.68 Kb. Скачать 60.68 Kb.
|
|
ЛАБОРАТОРНАЯ РАБОТА № 2 СПЕКТР ИЗЛУЧЕНИЯ АТОМАРНОГО ВОДОРОДАОзнакомьтесь с теорией в конспекте и учебнике (Савельев, т.3, 12, 28). Запустите программу «Эл-магн.Кванты». Выберите «Квантовая физика», «Постулаты Бора». Нажмите вверху внутреннего окна кнопку с изображением страницы. Прочитайте краткие теоретические сведения. Необходимое запишите в свой конспект. (Если вы забыли, как работать с системой компьютерного моделирования, прочитайте ВВЕДЕНИЕ стр.5 еще раз). ЦЕЛЬ РАБОТЫ: Знакомство с планетарной и квантовой моделями атома при моделировании процесса испускания электромагнитного излучения возбужденными атомами водорода. Экспериментальное подтверждение закономерностей формирования линейчатого спектра излучения атомарного водорода при низких давлениях. Экспериментальное определение постоянной Ридберга. КРАТКАЯ ТЕОРИЯ: СПЕКТРОМ электромагнитного излучения (ЭМИ) называется совокупность электромагнитных волн, излучаемых или поглощаемых атомами (молекулами) данного вещества. ЛИНЕЙЧАТЫЙ спектр состоит из отдельных компонент (линий), близких к гармоническим. Расстояние между линиями (по шкале длин волн или частот) много больше ширины линий. Такой спектр излучают атомарные газы. Кроме линейчатого выделяют еще ПОЛОСАТЫЙ спектр, который излучают молекулярные газы и СПЛОШНОЙ спектр, излучаемый нагретыми твердыми телами. ПЛАНЕТАРНАЯ МОДЕЛЬ атома: в центре атома расположено очень малое положительно заряженное ядро, вокруг которого по определенным (разрешенным) стационарным орбитам движутся электроны, масса которых во много раз меньше массы ядра. При движении по орбите электрон не испускает электромагнитного излучения (ЭМИ). При поглощении ЭМИ (фотона) электрон переходит на более «высокую» разрешенную орбиту, на которой его энергия становится больше на величину ЕЭЛ, равную энергии поглощенного фотона ЕФ. При обратном переходе электрон испускает фотон с такой же энергии ЕФ = |ЕЭЛ |. КВАНТОВАЯ модель атома отличается от планетарной в первую очередь тем, что в ней электрон не имеет точно определенной координаты и скорости, поэтому бессмысленно говорить о траектории его движения. Можно определить (и нарисовать) только границы области его преимущественного движения (орбитали). УРАВНЕНИЕ ШРЕДИНГЕРА для движения электрона в кулоновском поле ядра атома водорода используется для анализа квантовой модели атома. В результате решения этого уравнения получается волновая функция, которая зависит не только от координаты  и времени t, но и от 4-х параметров, имеющих дискретный набор значений и называемых квантовыми числами. Они имеют названия: главное, азимутальное, магнитное и магнитное спиновое. и времени t, но и от 4-х параметров, имеющих дискретный набор значений и называемых квантовыми числами. Они имеют названия: главное, азимутальное, магнитное и магнитное спиновое.Главное квантовое число n может принимать целочисленные значения 1, 2, ... . Оно определяет величину энергии электрона в атоме 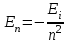 , где Еi - энергия ионизации атома водорода (13.6 эВ). , где Еi - энергия ионизации атома водорода (13.6 эВ).АЗИМУТАЛЬНОЕ (ОРБИТАЛЬНОЕ) квантовое число l определяет модуль момента импульса электрона при его орбитальном движении 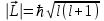 . Оно принимает целочисленные значения l = 0, 1, 2, ... n-1 . . Оно принимает целочисленные значения l = 0, 1, 2, ... n-1 .МАГНИТНОЕ квантовое число ml определяет проекцию вектора момента импульса орбитального движения электрона LZ на направление внешнего магнитного поля 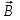 . Оно принимает положительные и отрицательные целочисленные значения, по модулю меньшие или равные l . . Оно принимает положительные и отрицательные целочисленные значения, по модулю меньшие или равные l .  , где ml = 0, 1, 2, ... , l. , где ml = 0, 1, 2, ... , l.МАГНИТНОЕ спиновое квантовое число mS определяет проекцию вектора собственного момента импульса электрона (СПИНА 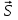 ) на направление внешнего магнитного поля ) на направление внешнего магнитного поля 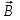 : : SZ =  mS и принимает только 2 значения: mS = +1/2, -1/2. Для модуля спина mS и принимает только 2 значения: mS = +1/2, -1/2. Для модуля спина  , где s – спиновое квантовое число, которое у каждой частицы имеет только одно значение. Например, для электрона s = , где s – спиновое квантовое число, которое у каждой частицы имеет только одно значение. Например, для электрона s =  (аналогично, для протона и нейтрона). Для фотона s = 1. (аналогично, для протона и нейтрона). Для фотона s = 1.ВЫРОЖДЕННЫМИ называются состояния электрона с одинаковой энергией. КРАТНОСТЬ ВЫРОЖДЕНИЯ равна количеству состояний с одной и той же энергией. КРАТКАЯ запись состояния электрона в атоме: ЦИФРА, равная главному квантовому числу, и буква, определяющая азимутальное квантовое число:
ПРАВИЛО ОТБОРА азимутального квантового числа l= 1. Электрон в атоме может переходить только между состояниями, удовлетворяющему указанному правилу. СПЕКТРАЛЬНОЙ СЕРИЕЙ называется совокупность линий излучения, соответствующих переходу электрона в атоме на один и тот же нижний уровень энергии:
МЕТОДИКА и ПОРЯДОК ИЗМЕРЕНИЙ Внимательно рассмотрите рисунки.  Зарисуйте необходимое в свой конспект лабораторной работы. Получите у преподавателя допуск для выполнения измерений. ИЗМЕРЕНИЯ Нажмите мышью кнопку «Старт» вверху экрана. Подведите маркер мыши к уровню энергии электрона с номером n0, указанным в таблице 2 для вашей бригады и нажмите левую кнопку мыши. Наблюдайте и зарисуйте мигающие стрелки на модели атома водорода (в левом верхнем поле), а также стрелки в правом поле и отметки в нижнем поле, соответствующие линиям в данной серии. Запишите в таблицу 1 величину главного квантового числа n0 для нижнего уровня энергии данной серии, название серии и длины волн отдельных линий.
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЕТА: Вычислите и запишите в таблицу 1 обратные длины волн. Определите, переходу между какими квантовыми состояниями электрона в атоме водорода соответствует каждая линия излучения. Запишите в таблицу значения n. Постройте график зависимости обратной длины волны (1/) от обратного квадрата главного квантового числа (1/n2 ) для данной спектральной серии. Определите по наклону графика значение постоянной Ридберга 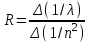 . .Запишите ответ и проанализируйте ответ и графики. ТАБЛИЧНОЕ ЗНАЧЕНИЕ: Постоянная Ридберга R = 1.1107 м-1 . Вопросы и задания для самоконтроля Что такое спектр электромагнитного излучения (ЭМИ)? Что такое линейчатый спектр ЭМИ? Что является источником линейчатого спектра ЭМИ? Что такое полосатый спектр ЭМИ и что является его источником? При каких условиях излучается сплошной спектр ЭМИ? Опишите планетарную модель атома. При каких условиях электроны в атоме излучают или поглощают ЭМИ? Как связаны друг с другом характеристики фотона и электрона, который излучает данный фотон? Какое уравнение используется для анализа квантовой модели атома? Что является решением этого уравнения? Как описывается электрон и его движение в квантовой модели атома? Что определяет квадрат модуля волновой функции? Дайте определение орбитали электрона в атоме. Что определяет главное квантовое число? Напишите формулу для его нахождения. Что определяет азимутальное квантовое число? Напишите формулу для его нахождения. Что определяет магнитное квантовое число? Напишите формулу для его нахождения. Что такое спин электрона? Что определяет спиновое квантовое число? Напишите формулу для его нахождения. Что определяет магнитное спиновое квантовое число? Напишите формулу для его нахождения. Что такое вырожденные состояния? Как определить кратность вырождения состояния? Расшифруйте краткую запись состояния электрона в атоме (2s2 , 2p3). Может ли электрон иметь состояние 2d и почему? Сформулируйте правило отбора. Что такое спектральная серия? Назовите названия спектральных серий излучения атомарного водорода. Запишите условия для их возникновения. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
