Лабораторная работа 3 Теплоемкость идеального газа Цель работы Результаты измерений и расчетов 1
 Скачать 112.91 Kb. Скачать 112.91 Kb.
|
|
Лабораторная работа № 3 «Теплоемкость идеального газа» Цель работы: Результаты измерений и расчетов: 1. Одноатомный газ: 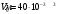 , , 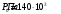 , , 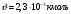 Таблица 2
Графики зависимостей QV=f(T) и Qp=f(T) для одноатомного газа (на одном чертеже) по табл.2. 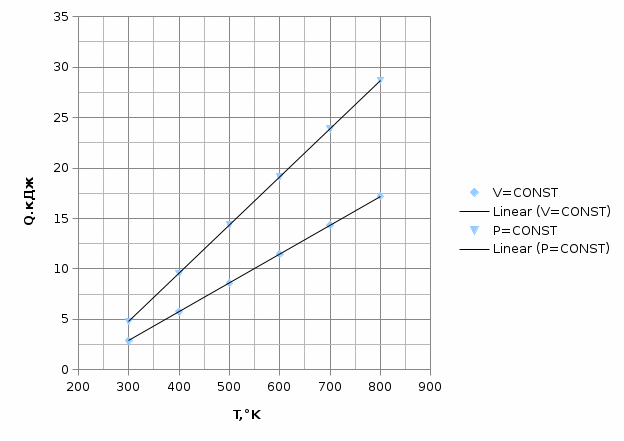 Определение Cp теплоемкости и cp молярной теплоемкости газа при постоянном давлении: 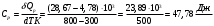 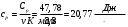 Определение CV теплоемкости и cV молярной теплоемкости газа при постоянном объеме: 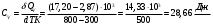 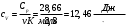 Определение γ постоянной адиабаты: 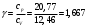 Определение iчисла степеней свободы молекул газов: 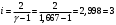 2. Двухатомный газ: 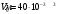 , , 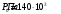 , , 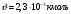 Таблица 3
Графики зависимостей QV=f(T) и Qp=f(T) для двухатомного газа (на одном чертеже) по табл.3: 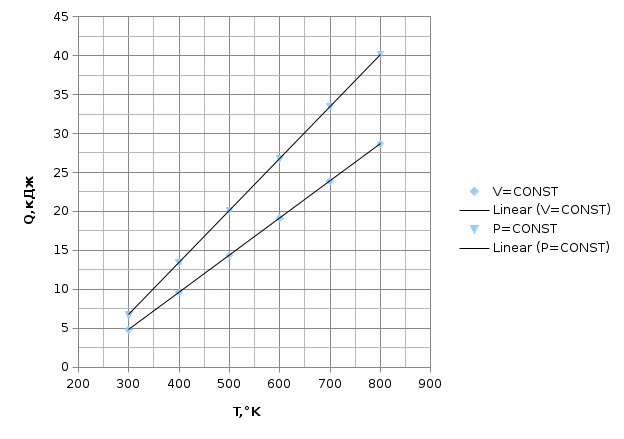 Определение Cp теплоемкости и cp молярной теплоемкости газа при постоянном давлении: 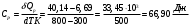 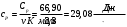 Определение CV теплоемкости и cV молярной теплоемкости газа при постоянном объеме: 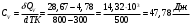 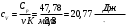 Определение γ постоянной адиабаты: 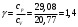 Определение iчисла степеней свободы молекул газов: 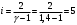 3. Трехатомный газ: 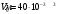 , , 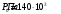 , , 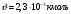 Таблица 4
Графики зависимостей QV=f(T) и Qp=f(T) для трехатомного газа (на одном чертеже) по табл.4: 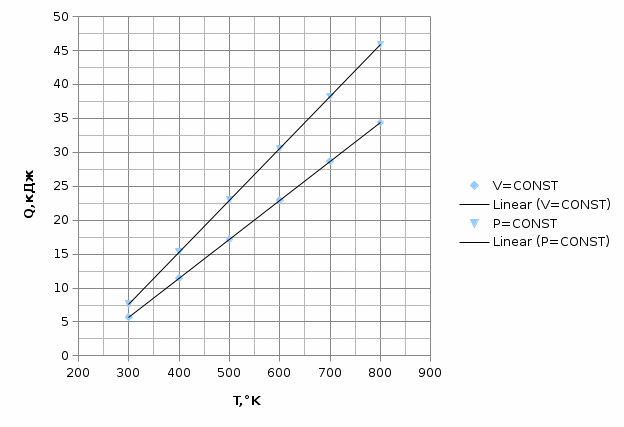 Определение Cp теплоемкости и cp молярной теплоемкости трехатомного газа при постоянном давлении: Определение Cp теплоемкости и cp молярной теплоемкости газа при постоянном давлении: 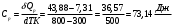 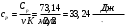 Определение CV теплоемкости и cV молярной теплоемкости газа при постоянном объеме: 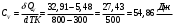 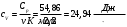 Определение γ постоянной адиабаты: 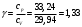 Определение iчисла степеней свободы молекул газов: 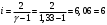 Вывод: Познакомились с теплоемкостью идеального газа в изохорическом и изобарическом процессах, экспериментальное подтвердили закономерности при изобарическом и изохорическом процессах и вычислили теплоемкости для этих процессов, экспериментально определили количества степеней свободы и структуры молекул одноатомного, двухатомного и трехатомного газов в данной модели. |
