обмен белов. обмен белков. Лабораторная работа 5 Обмен белковых веществ
 Скачать 1.36 Mb. Скачать 1.36 Mb.
|
|
Лабораторная работа 5 Обмен белковых веществ Цель работы: освоение лабораторных методов анализа содержания отдельных продуктов, а также некоторых интегральных показателей метаболизма белковых веществ, отражающих некоторые особенности превращения азотсодержащих соединений в организме. Приборы и реактивы: центрифуга, стеклянные палочки, сухие чистые пробирки, колбы Кьельдаля, электрическая плитка, мерные колбы объемом 25 мл, 50 мл, 250 мл и 500 мл, пипетки Мора, бюретка, водяная баня, спектрофотометр или фотоэлектроколориметр, делительная воронка, хроматографическая камера, пластинки для ТСХ, чашки Конвея, чашки для выпаривания, мерные цилиндры, автоматические дозаторы, сущильный шкаф, кристаллические аминокислоты, (NH4)2SO4, водные растворы трихлоруксусной кислоты (30 %-ный), H2O2 (30 %-ный), NaOH (10 %-ный и 1 н), сегнетовой соли (25 %-ный), CH3COOH (0,04 М), нингидрина (1 %-ный), K2CO3 (насыщенный), H2SO4 (1 н), спиртовой раствор фенолфталеина, раствор нингидрина в ацетоне (0,2 %-ный масс/об), реактив Несслера, концентрированные H2SO4, CH3COOH, HCOOH, н-бутанол, вазелин. Опыт 5. Разделение и идентификация аминокислот сыворотки крови Для разделения, качественного и количественного анализа аминокислот в биологических жидкостях используют различные виды хроматографии – бумажную, тонкослойную, колоночную, в основе которых могут лежать ионообменный, распределительный, адсорбционный и др. механизмы. В данной работе предлагается реализовать процедуру разделения аминокислот безбелковой сыворотки крови методом тонкослойной хроматографии на пластинках «Silufol». Заранее готовят подвижную фазу, смешивая н-бутанол, CH3COOHи H2O в соотношении 4:1:5 и встряхивая смесь в течение 10 минут. После чего смесь переносят в делительную воронку и оставляют до полного расслоения. На дно хроматографической камеры наливают верхний слой (бутанол, насыщенный уксусной кислотой и водой) толщиной 1-2 см. Камеру герметично закрывают и выдерживают в течение не менее 30 минут для насыщения парами. Для отделения белков около 1-2 мл сыворотки крови смешивают с таким же количеством 0,04 н раствора CH3COOH в центрифужной пробирке, после чего смесь нагревают на кипящей водяной бане в течение 5 минут и охлаждают. Осадок белка отделяют центрифугированием в течение 10 минут при скорости вращения ротора 3000 об/мин. Затем центрифугат переливают в сухую чистую чашку для выпаривания и упаривают досуха на асбестовой сетке. Сухой остаток растворяют в 200-300 мкл смеси HCOOH:CH3COOH:H2O=7:5:3 (или изопропанол:H2O=1:9), а прозрачный раствор отделяют от нерастворившегося остатка центрифугированием. На стартовую линию на расстоянии 1,5 см от края пластинки наносят 20-30 мкл раствора небольшими порциями для исключения образования пятен большого диаметра. Также на пластинку на расстоянии 1,5-2 см друг от друга наносят растворы имеющихся в лаборатории аминокислот-«свидетелей» с концентрацией 50 ммоль/л (наносимый раствор должен содержать 0,05-0,1 мкмоль аминокислоты). В качестве растворителя для аминокислот также используют смесь HCOOH,CH3COOHиH2O или изопропанола и H2O. После этого пластинку помещают в хроматографическую камеру и выдерживают до тех пор, пока фронт элюента не поднимется на высоту 12-13 см. Затем пластинку вынимают и после отметки положения фронта элюента высушивают в сушильном шкафу при температуре около 100 оС. Для проявления хроматограммы пластинку обрабатывают 0,2 %-ным раствором нингидрина в ацетоне и снова помещают в сушильный шкаф. Качественный анализ смеси аминокислот может быть получен проведен по значениям подвижности 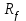 для обнаруженных пятен, а также по их цвету. Так, гистидин и глицин дают красно-серые пятна; фенилаланин, тирозин и аспарагиновая кислота – синие; триптофан – коричневые; аспарагин – грязно-желтые; пролин – желтые. для обнаруженных пятен, а также по их цвету. Так, гистидин и глицин дают красно-серые пятна; фенилаланин, тирозин и аспарагиновая кислота – синие; триптофан – коричневые; аспарагин – грязно-желтые; пролин – желтые. Результаты анализа хроматограммы представляют в таблице 5. Таблица 6 – Результаты разделения аминокислот сыворотки крови
Из анализа внешнего вида хроматограммы и данных таблицы 5 делают вывод об аминокислотном составе исследуемой сыворотки крови. Для сравнительной оценки количественного содержания аминокислот в сыворотке крови в тетради приводят изображение или фотографию пластинки, на которых отражены размеры пятен. Делают вывод о соотношении концентраций отдельных аминокислот в пробе и сравнивают его с данными таблицы 6. Таблица 6 – Концентрация свободных аминокислот в сыворотке крови человека
 Рисунок 1 – Изображение пластинки с хромотограммой. В отчете дают объяснения высоким значениям концентраций аланина и глутамина в сыворотке крови. Вывод: основным является перенос из крови в печень свободного азота тк его много, тем самым участвуя в выводы аммиака из организма | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
