Лабораторная работа по Точке Роста. Лабораторная работа _Определение рН растворов_. Лабораторная работа Определение рН растворов (с использованием цифровой лаборатории releon) Реактивы и приборы
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
|
Лабораторная работа Определение рН растворов (с использованием цифровой лаборатории RELEON) Реактивы и приборы: Перечень датчиков ЦЛ: цифровая лаборатория RELEON с датчиком рН. Дополнительное оборудование: лабораторные стаканы на 50-100 мл, штатив лабораторный с держателем и зажимом, вода дистиллированная, по 30 мл 0,1 М раствора HCl, NaOH , CH3COOH, NH3, фильтровальная бумага. Тема: Определение pH сильных и слабых электролитов (с использованием цифровой лаборатории). Цель работы: Сформировать представление о рН как о характеристике кислотности среды. Техника безопасности Приступая к работе, соблюдать специальные меры безопасности при работе с кислотами и сильно пахнущими веществами. Ход работы 1. Закрепим датчик рН в лапке штатива. 2. Подключаем датчик рН к USB-входу компьютера. 3. В химический стакан налили 25–30 мл серной кислоты и погрузили датчик в раствор не менее чем на 2 см. 4. Запускаем программу измерений Releon Lite и нажмаем «Пуск». 6. Подождем установления показаний в течение нескольких секунд и нажмите кнопку «Пауза» (зафиксируем показания). 7. Вынимаем из стакана датчик и тщательно промываем датчик дистиллированной водой и осушим бумажным фильтром. 8. Повторяем измерения с раствором уксусной кислоты, гидроксида натрия, аммиака, водопроводной водой). 9. Результаты полученных измерений вносим в таблицу. Таблица. Результаты измерений
Контрольные вопросы и выводы: 1. Расставьте исследованные растворы в порядке увеличения рН. (HCl, CH3COOH, вода, NH4OH, NаOH.) 2. Как вы думаете, с чем может быть связано отличие рН водопроводной воды ? (рН водопроводной воды зависит от ее источника: от того, с какими пододами- кислыми ил щелочными – контактирует водоем.) 3. Какую среду имеют исследованные растворы? (HCl, CH3COOH – кислая среда; вода- нейтральная среда; NH4OH, NаOH- щелочная среда). 4. Можно ли с помощью фенолфталеина отличить кислую среду от нейтральной? Щелочную среду от нейтральной? (Кислую среду от нейтральной отличить нельзя. Щелочную от нейтральной – можно.) 5. Оцените приблизительно значение рН , при котором происходит изменение окраски метилоранжа и фенолфталеина. (Метилоранж: между 3 и 7 (реально 3,1- 4,0);Фенолфталеин – между 7 и 11 (реально 8,2-10.0)). Приложение     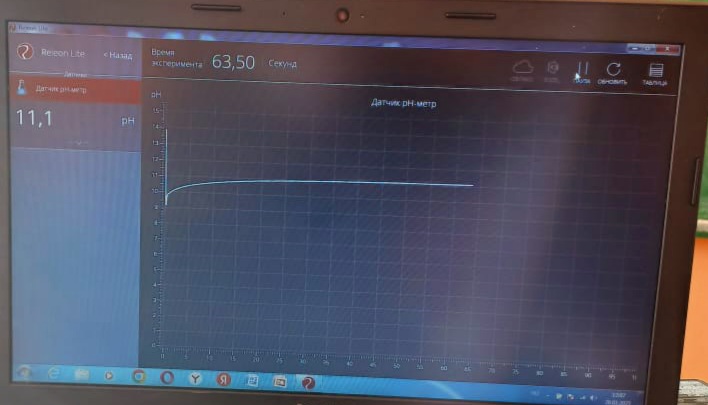 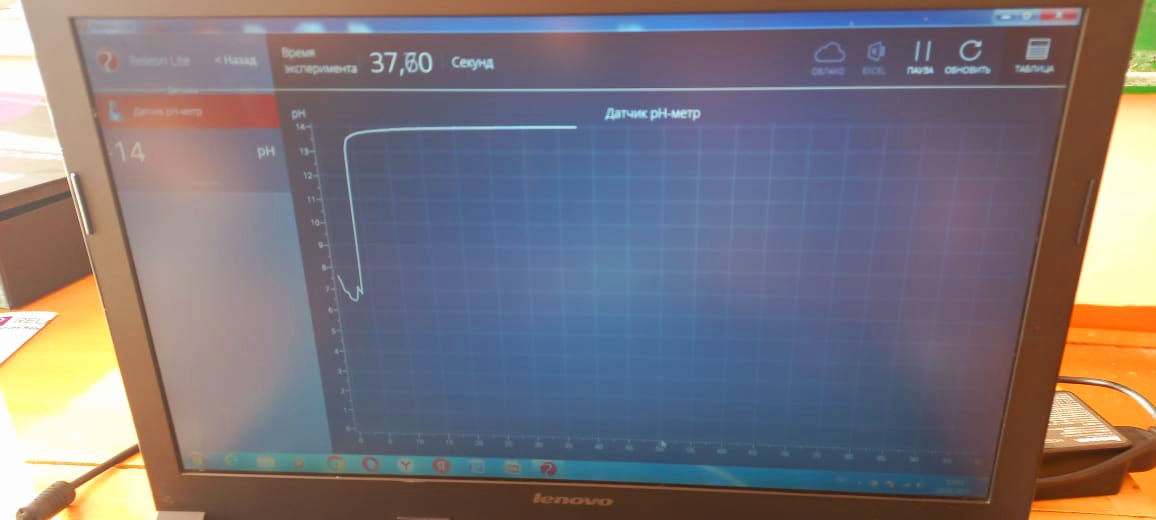  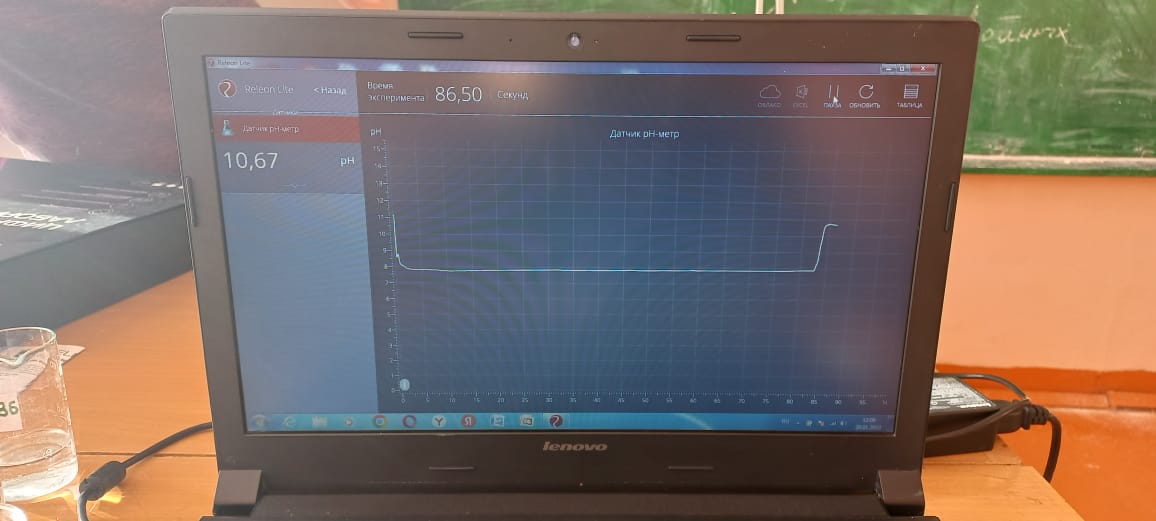  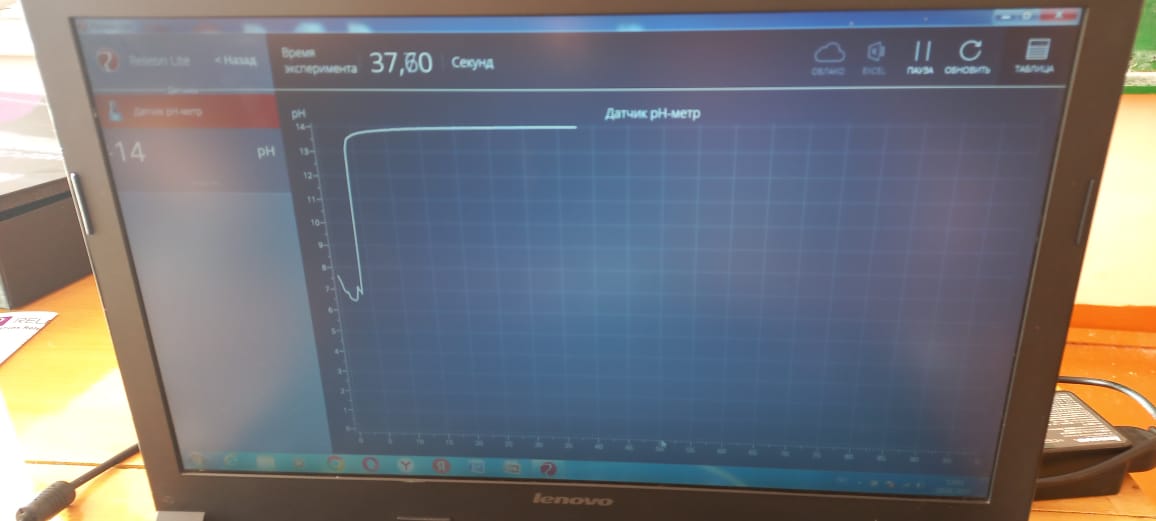  | ||||||||||||||||||||||||||
