Лабораторная работа по химии. Определение молярной массы эквивалента металла. Косяк Анна Факультет нук рлм
 Скачать 133 Kb. Скачать 133 Kb.
|
|
М Г Т У и м е н и Н. Э. Б а у м а н а Лабораторная работа по химии. «Определение молярной массы эквивалента металла». Выполнила: Косяк АннаФакультет: НУК РЛМ Группа: БМТ2 - 12 Дата выполнения: 17. 09. 2004 Дата сдачи: 24. 09. 2004 М О С К В А2 0 0 4 Цель работы. Усвоить понятие эквивалент и молярная масса эквивалента и ознакомиться с одним из методов определения молярной массы эквивалента металла – объемным методом. Теоретическая часть. Эквивалент – это часть молекулы (атома) вещества, равноценная в химической реакции одному атому или иону водорода или одному электрону. Соответственно, молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль. Расчет молярной массы эквивалента вещества осуществляется по следующим правилам: Химические элементы. Мэ = М / n Где Мэ – молярная масса эквивалента элемента, М – молярная масса элемента, n - валентность. Кислоты и основания. Мэ = М / n Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – основность кислоты или кислотность (количество групп ОН) основания.Соли и оксиды. Мэ = М / (N * n) Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, N – количество катионов в формуле, n – формальный заряд катиона. Окислители и восстановители. Мэ = М / n Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – количество электронов, присоединяемое одной молекулой окислителя или отдаваемое одной молекулой восстановителя. Молярная масса одного итого же вещества может рассчитываться по – разному, в зависимости от его химических свойств. Для экспериментального определения молярной массы эквивалента вещества необходимо найти массу данного вещества, равноценную в химической реакции молярной массе эквивалента другого известного вещества. Практическая часть. а) Название опыта. Опыт по определению молярной массы эквивалента неизвестного металла. б) Ход эксперимента. Вначале необходимо ознакомиться с прибором, привести его в начальное состояние: бюретка должна находиться на таком расстоянии от поверхности лабораторного стола, чтобы ее можно было опустить вниз на 20 – 30 см. Оценить цену деления бюретки. Отводную трубку пробирки и пробку, закрывающую отводную трубку необходимо досуха протереть фильтровальной бумагой. Получить образец металла у преподавателя и записать его массу. Образец металла поместить в отводную трубку и расположить примерно на ее середине. После этого плотно закрыть пробирку. Провести проверку прибора на герметичность. Для этого передвинуть бюретку на 10 – 15 см. и наблюдать за изменением уровня воды в бюретке в течение 1 – 2 минут. Если высота уровня остается постоянной, то прибор герметичен, если нет, то нужно более плотно вставить пробки в бюретку, пробирку и отводную трубку. С помощью бюретки уравнять уровни воды в бюретках и записать показания бюретки, т. е. начало отсчета. Показания бюретки нужно определять по нижнему краю мениска воды. После проведения этих приготовлений прибора к работе, можно начинать опыт. Для этого приподнять пробирку и постучать пальцем по отводной трубке пробирки, чтобы образец металла переместился из отводной трубки в раствор кислоты. Наблюдать за протеканием реакции. Дождаться окончания реакции. После окончания реакции между металлом и кислотой и охлаждением реакционного сосуда выровнять уровни воды в бюретках и записать положение уровня воды в бюретке, тем самым, определив значение Vк - конечную точку отсчета объема выделившегося водорода. в) Наблюдения. В результате реакции наблюдается выделение газа. Изменяется уровень воды в бюретке. г) Уравнение реакции. Mg + 2HCl = MgCl2 + H2 д) Проведение расчетов. Дано: Решение. Vн = 1, 8 мл m * 11200 * (273 + tком.) * P0 Vк = 15, 6 мл Мэ(эксп.) = ————————————— Рат. = 749 мм рт. ст. V * 273 * (Pат. – PH2O) Р0 = 760 мм рт. ст. tком. = 230 V = |Vk – Vн| = 15, 6 мм – 1, 8 мм = 13, 8 мм M  = 0, 125 г Так как tком = 230, то PH2O = 21, 07 мм рт. ст. Найти: Мэ 0, 0125 * 11200 * (273 + 23) * 760 Мэ(эксп.) = ——————————————— = 11, 48г 13, 8 * 273 * (749 – 21, 07) После расчета молярной массы эквивалента металла по результатам проведенного опыта надо идентифицировать металл по его молярной массе. Для этого по формуле М (Ме) = n * Мэ(Ме) рассчитать молярную массу для трех значений валентности (степени окисления) n, равных 1, 2 и 3. n = 1 М (Ме) = 1 * 11, 48 = 11, 48 г/моль n = 2 М (Ме) = 2 * 11, 48 = 22, 9 г/моль n = 3 М (Ме) = 3 * 11, 48 = 34, 4 г/моль По таблице Д. И, Менделеева выбирается металл, проявляющий соответствующую валентность, для которого расхождение с табличными данными не превышает 1 – 2 г/моль. В нашем случае подходит металл 2 группы Mg. После этого надо рассчитать теоретическое значение Мэ(теор.): Мэ(эксп.) - Мэ(теор.) Мэ(теор.) = М (Ме) / n; η = —————————— * 100%; Мэ(теор.) Мэ(теор.) = 22, 9 / 2 = 11, 45 г/моль И ошибку экспериментального определения молярной массы эквивалента металла η по формулам: Мэ(эксп.) - Мэ(теор.) η = —————————— * 100%; Мэ(теор.) 11,48 – 11, 45 η = ——————— * 100% = 0, 002 * 100% = 0, 2% 11, 45 е) Иллюстрационный материал 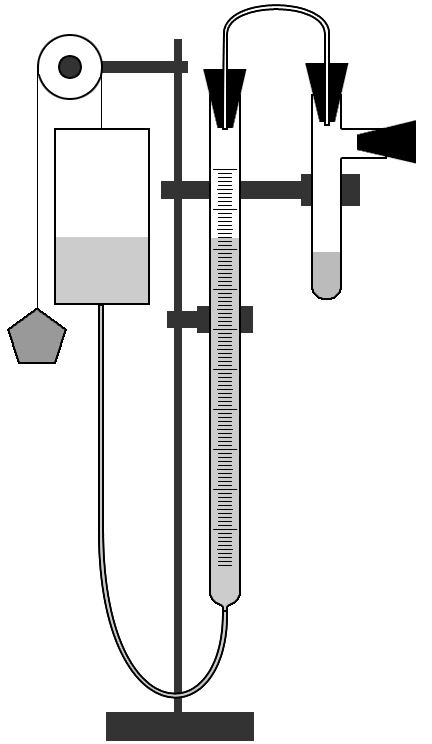 ж) Вывод. Так как погрешность проведенных расчетов не превышает 5 % и на основании таблицы Менделеева, можно утверждать, что полученный у преподавателя металл является магнием. Контрольные вопросы. Что такое эквивалент и молярная масса эквивалента? Эквивалент – это часть молекулы (атома) вещества, равноценная в химической реакции одному атому или иону водорода или одному электрону. Молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль. Как рассчитывается молярная масса эквивалента вещества для химических элементов и соединений различных классов (соли, оксиды, кислоты, основания), а также для соединений, проявляющих свойства окислителей или восстановителей? Молярная масса рассчитывается по следующим правилам: Химические элементы. Мэ = М / n Где Мэ – молярная масса эквивалента элемента, М – молярная масса элемента, n - валентность. Кислоты и основания. Мэ = М / n Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – основность кислоты или кислотность (количество групп ОН) основания.Соли и оксиды. Мэ = М / (N * n) Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, N – количество катионов в формуле, n – формальный заряд катиона. Окислители и восстановители. Мэ = М / n Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – количество электронов, присоединяемое одной молекулой окислителя или отдаваемое одной молекулой восстановителя. Рассчитать молярную массу эквивалента перманганата калия KMnO4, рассматривая данное соединение как: а) соль; Мэ = М / (N * n) = (39 + 56 + 16 * 4) / 1 = 159 г/моль б) окислитель, превращающийся в MnO(OH)2; Mn+7+ 3ē = Mn+4 Мэ = М / n = (39 + 56 + 16 * 4) / 3 = 53 г/моль в) окислитель, превращающийся в MnSO4 Mn+7 + 6ē = Mn+2 Мэ = М / n = (39 + 56 + 16 * 4) / 5 = 31, 8 г/моль Какой объем оксида углерода СО, взятый при нормальных условиях требуется для получения железа из 1 кг его оксида Fe2O3? Мэ(Fe2O3) = (2 * 56 + 3 * 16) / (1 * 3) = 53, 3 г/моль 1кг x 3Fe2O3 + СО = 2Fe3O4 + CO2 n = 3 моль n = 1 моль Mэ = 53, 3 г/моль Vm = 22, 4 л/моль m  = 159, 9 г V = 22, 4 л 1 кг х 159, 9 г - 22, 4 л 1 кг - х 1000 г * 22, 4 л х = ———————— = 140 л 159, 9 г Ответ: V(CO) = 140 л Рассчитать молярную массу эквивалента азотной кислоты HNO3, рассматривая данное соединение как: а) кислоту Мэ = М / n = (1 + 14 + 3 * 16) / 1 = 63 г/моль б) окислитель, превращающийся в NO N+5 + 3ē = N+2 Мэ = М / n = (1 + 14 + 3 * 16) / 3 = 21 г/моль в) окислитель, превращающийся в NH3 N+5 + 8ē = N-3 Мэ = М / n = (1 + 14 + 3 * 16) / 8 = 7, 8 г/моль Какое количество серной кислоты H2SO4 необходимо для реакции с 300г оксида алюминия Al2O3 при условии образования средней соли Al2(SO4)3 ? Мэ(H2SO4) = М / n = (2 + 32 + 16 * 4) / 2 = 49 г/моль Мэ(Al2O3) = М / (N * n) = (2 * 27 + 3 * 16) / (2 * 3) = 17 г/моль х 300г 3 H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O n = 3 моль n = 1 моль Мэ = 49 г/моль Мэ = 17 г/моль m = 147 г m = 17 г/моль  х 300г 147г – 17г х – 300г 147г * 300г х = —————— = 2594г 17г Ответ: m (H2SO4) = 2594г |
