Лабораторная работа №3м (2). Лабораторная работа Тепловой эффект реакции нейтрализации Цель работы
 Скачать 289 Kb. Скачать 289 Kb.
|
|
Лабораторная работа 3. Тепловой эффект реакции нейтрализации Цель работы. Освоить методику калориметрических измерений; определить тепловой эффект реакции нейтрализации серной кислоты щелочью; овладеть термохимическими расчетами. Химический процесс. Серную кислоту можно нейтрализовать двумя способами. Первый способ – это последовательная нейтрализация в две стадии. Второй способ – полная нейтрализация серной кислоты в одну стадию. При этом необходимо учитывать, что серная кислота является слабой кислотой по второй ступени диссоциации с Кдис= 1,2·10-2. Экспериментальная часть. Определение теплового эффекта реакции производила прибором, называемым калориметром. Простейший из них изображен на рисунке 2. Опыт 1. Нейтрализация серной кислоты в две стадии. В 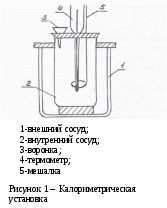 калориметрический стакан налил 50 см3 1М раствора серной кислоты (H2SO4). Измерил температуру (t1). В два цилиндра отмерил по 25 см3 2М раствора гидроксида натрия (NaOH). В раствор кислоты быстро и без потерь вылил из первого цилиндра щелочь. Перемешал путем встряхивания полученный раствор соли NaHSO4 и быстро измерил максимальную температуру (t2). К полученному раствору соли NaHSO4 быстро прилил раствор NaOH из второго цилиндра и после перемешивания измерил максимальную температуру (t3) раствора средней соли Na2SO4. Результаты опыта занёс в таблицу 1 (1,2). Опыт 2. Нейтрализация серной кислоты в одну стадию. В калориметрический стакан налил 50 см3 1М раствора серной кислоты. Измерил температуру (t1). В цилиндр налил 50 см3 2М раствора щелочи NaOH. В раствор кислоты быстро и без потерь вылил из цилиндра щелочь. Перемешал путем встряхивания полученный раствор средней соли Na2SO4. Измерил максимальную температуру (t2). Результаты опыта занёс в таблицу 1 . Таблица 1
Таблица 2
Обработка результатов опыта Теплота, выделяющаяся в результате реакции нейтрализации, вычисляется по формуле где 10–3 – переводной коэффициент Дж в кДж. Введение эффективной удельной теплоемкости раствора связано с тем, что тепловой эффект реакции нейтрализации расходуется не только на нагревание самого раствора, но и нагревании стенок внутренней части колориметра (стеклянного стакана), причем масса этой части системы строго говоря неизвестна, на нагревание термометра, на испарение воды при росте температуры раствора и т.д. Из-за относительно малых объемов кислоты и основания влияние этих факторов значительно, и для учета этого влияния вводят так называемую «постоянную калориметра», которая в нашей случае заменена эффективной теплоемкостью растворов. 1. Рассчитал тепловой эффект первой и второй стадии реакции нейтрализации в первом опыте. 2. Рассчитал тепловой эффект реакции нейтрализации во втором опыте. 3. На основании следствия из закона Гесса рассчитал теоретический тепловой эффект реакции нейтрализации серной кислоты щелочью, при известных теплотах образования продуктов реакции и исходных веществ, которые даны в таблице 2. Вследствие того, что разница тепловых эффектов в обоих опытах незначительна, можно сделать вывод, что следствие закона Гесса выполняется. Вывод: В ходе выполнения лабораторной работы, я освоил методику калориметрических измерений, овладел термохимическими расчетами, определил тепловой эффект реакции нейтрализации серной кислоты щелочью двумя способами. Тепловой эффект в первом опыте был равен | |||||||||||||||||||||||||||||||||||||||||||
