Антигены, антитела. Лекция. Антигены и антитела. Лекция Антигены. Антитела
 Скачать 0.76 Mb. Скачать 0.76 Mb.
|
|
Лекция: « Антигены. Антитела» План лекции 1. Виды антигенов. 2. Свойства антигенов. 3. Виды антигенной специфичности. 4. Специфичность антител. 5. Свойства, функции и типы антител. 6. Динамика выработки антител. 7. Моноклональные антитела. Антиген – биополимер органической природы, генетически чужеродный для макрооганизма, который при попадании в него распознаётся иммунной системой и вызывает иммунные реакции, направленные на его устранение. Критерии антигенности (признаки АГ): Макромолекулярность (масса не менее 1 000-5 000 Да). Молекулярная масса имеет решающее значение для проявления антигенности. Яичный альбумин (молекулярная масса 40 000) и сывороточный альбумин (молекулярная масса 70 000) являются самыми низкомолекулярными антигенами. Имеются вещества, обладающие специфичностью, но из-за малой массы не способные вызывать образование антител: рибонуклеаза (молекулярная масса 14 000), инсулин (молекулярная масса 6 000). Они вызывают реакции иммунитета только в смеси с другими антигенами. К их числу относится полный адъювант Фрейнда (квасцы в смеси с вакциной БЦЖ), пирогенал, бактериальные липополисахариды. Жесткая структура молекулы (стабильность структуры). Чужеродность. Чужеродность — главное свойство антигенов. Без чужеродности нет антигенной активности, ибо организм работает по принципу реакции на все, что "не Я". Альбумин кролика не является антигеном для кролика, так как он не несет для этого животного никакой чужеродной генетической информации. Но альбумин кролика — антиген для человека, собаки, морской свинки и других видов животных, так как для них он является генетически чужеродным. Способность участвовать в метаболических процессах организма. Любое ли вещество, имеющее данные признаки, может считаться АГ? Нет. Необходим ряд характеристик, которые определяют антигенность — свойства АГ. Свойства А Г: Специфичность — способность АГ взаимодействовать с гомологичными AT, рецепторами. Наибольшее значение в иммунологической специфичности антигена имеют поверхностно расположенные химические группы. Их называют детерминантами. Крупные естественные белковые молекулы несут на себе несколько детерминантных групп. Антигенность — способность АГ вызывать ответные иммунные реакции: клеточные реакции иммунного ответа и образование AT. Иммуногенность — способность вызывать образование протективных (защитных) AT; измеряется в международных иммуногенных единицах (ИЕ). Эта характеристика микробных антигенов демонстрирует их способность формировать иммунитет (невосприимчивость к инфекционным заболеваниям). Понятия антигенность и иммуногенность не идентичны. Например, возбудитель дизентерии обладает высокой антигенной активностью, но не формирует выраженного иммунитета против заражения патогенным возбудителем дизентерии. В отличие от этого брюшнотифозная вакцина обладает как высокой антигенностью, так и выраженной иммуногенностью. После иммунизации этой вакциной формируется иммунитет к заражению патогенным брюшнотифозным микробом. Основы специфичности АГ: состав аминокислот, их последовательность; особенности пространственной конфигурации концевых аминокислот; вторичная и третичная структуры белка; наличие радикалов глико-, липо- и нуклеопротеидной природы. 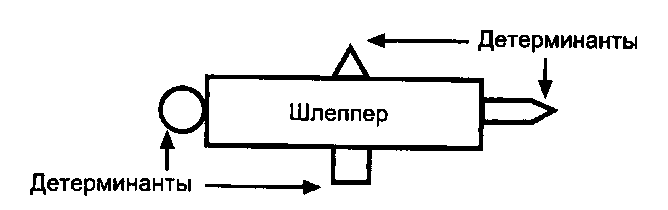 Поверхностные структуры АГ (химические группы), отвечающие за специфическое соединение с AT или рецептором, называются антигенными детерминантами, или эпитопами. Эпитоп — это часть молекулы АГ (около 10-16 аминокислотных остатков), которая находится на его поверхности и взаимодействует комплементарно с активным центром AT. Выделенная в химически чистом виде детерминантная группа не является антигеном. Для проявления ее антигенной активности необходима высокомолекулярная часть антигена, которая называется шлеппером или проводником антигенного раздражения. Таким образом, по структуре антиген состоит из двух частей: а) специфических детерминант и б) высокомолекулярного шлеппера. Виды антигенной специфичности Видовая — определяет различие между белками определенных видов. Эти различия закодированы в геноме, т.к. каждый ген контролирует синтез одного белка. Для определения белковых АГ чаще всего используют реакции преципитации. В лейкоцитах человека содержатся АГ, по химической природе они гликопротеиды. Видовая специфичность свойственна каждому виду животного организма. С помощью антител против сывороточных белков человека судебные медики легко отличают пятна крови человека от пятен крови животных. В Австралии иммунологи при помощи антител к тканям кенгуру легко обнаруживают пищевые добавки к сосискам, которые в этой стране разрешается делать только из говядины. Групповая — определяется различиями внутри одного вида. Например, Впервые в 1901 г. групповые антигенные различия описал немецкий ученый К. Ландштейнер на эритроцитах впервые определил АГ группы крови. В настоящее время в эритроцитах выявили 14 изоантигенных систем. Каждый организм отличается от другого организма своими изоантигенами. Типовая — характерна для одного вида микробов. Этот термин используется только по отношению к микробам. Например, пневмококки разделяются на серотипы по полисахаридным капсульным АГ на четыре типа, а возбудители ботулизма по характеру синтезируемого ими экзотоксина — на 5 типов. Органная — это специфичность некоторых органов, которые рано отделились за барьеры иммунной системы — например, мозг, хрусталик. Стадиоспецифичность — это появление в период эмбрионального развития необычных белков — фитопротеины у беременных. Патологическаяспецифичность — это появление необычных АГ при некоторых заболеваниях. К их числу относятся лучевые антигены при острой лучевой болезни и ожоговые антигены при ожогах. Они обладают токсичностью и отягощают течение основного заболевания. Патологические антигены имеют диагностическое значение в онкологии. Например, обнаружение у взрослого человека а-фетопротеина свидетельствует о первичном раке печени. Раково-эмбриональный антиген обнаруживают у больных раком толстой кишки, поджелудочной железы, молочной железы и легкого. Тканевый полипептидный антиген циркулирует в сыворотке при раке мочевого пузыря, предстательной железы и почек. Гетероспецифичность — это наличие общих АГ детерминант у различных видов животных и человека. Типичным примером гетероантигенов является антиген Форсмана. Этот антиген содержится в эритроцитах овец, лошадей, собак, кошек, мышей и кур. Но его нет в эритроцитах человека, обезьян, кроликов, крыс, уток. Или у эритроцитов человека 1-й группы и возбудителя чумы. Если микроорганизмы имеют общий АГ с тканями человека, это явление называют антигенной мимикрией. Гетероспецифичность может иметь эволюционное происхождение. Эволюция приводит к селекции микроорганизмов, которые уподобляются антигенам хозяина, становятся "невидимыми" для механизмов иммунитета, который воспринимает их как собственное "Я". Поэтому инфекционные заболевания, вызываемые микробами, имеющими общие детерминанты с человеческими тканями (например, чума), протекают особенно тяжело. Общими антигенами обладают сердечная мышца и некоторые белковые фракции стрептококка. Гемолитические стрептококки содержат М-протеин, общий с антигенами миокарда и клубочков почки человека, что способствует образованию антител против данных тканей и аутореактивных лимфоцитов. В результате инициируются иммунопатологические реакции и такие заболевания, как ревматизм и постстрептококковый гломерулонефрит. Гаптеновая специфичность — это специфичность, которую приобретает белковая молекула после соединения с той или иной гаптеновой детерминантой. Этот тип специфичности могут приобретать собственные белки организма, комплексируясь с антибитиками. Белок является шлеппером (проводником антигенного раздражения), а антибиотик — гаптеном, обеспечивающим выработку специфических антиантибиотиковых антител. Такие антитела нейтрализуют антибиотики и сенсибилизируют организм (повышают чувствительность) к их повторному применению, что проявляется шоковой реакцией. Помимо антибиотиков, способностью соединяться с собственными белками обладают сульфаниламидные препараты и многие химические вещества: диазобензол, дихлорбензол, анилин и др. После соединения с белками к этим химическим веществам образуются антитела. Функциональная специфичность — это сходство ряда антигенов, обусловленное одинаковыми функциями этих молекул в организме. Например, инсулин, альбумин крови, белки хрусталика глаза у всех млекопитающих имеют некоторые общие антигены. Их находят также в эритроцитах мыши и крысы. Искусственные антигены — это специально созданные химическим путем высокомолекулярные соединения. В настоящее время синтезирован сальмонеллезный антиген. Классификация антигенов I. По функциональным свойствам: Полноценные АГ Обладают антигенностью и специфичностью. По химической природе это белковые молекулы или конъюгаты (комплексы белков с полисахаридами, липидами, нуклеиновыми кислотами). Обеспечивают полноценную иммунную реакцию в организме. Все протекгивные АГ (индуцирующие образование AT в организме) являются полноценными АГ. Неполноценные АГ, или гаптены. Приобретают признаки чужерод ности, специфичности лишь при взаимодействии с белками и другими макромолекулами. У самих гаптенов недостаточная молекулярная масса. По химической природе чаще всего это полисахариды, нуклеиновые кислоты, липиды. При соединении с белками они приобретают свойства полноценных АГ. Такие белки, которые усиливают свойства АГ, называют шлепперами (проводники). II. По происхождению: Естественные АГ — микроорганизмы, их токсины, ферменты. Синтетические АГ. Аутоантигены — собственные клетки с измененной антигенной структурой (опухолевые, травмированные клетки, зараженные вирусами). III. По генетическим отношениям: Аугоантигены. Изоантигены - от генетически идентичного донора (идентичгых близнецов). Аллоантигены – общие антигены одного биологического вида. К ним относятся молекулы МНС I и II класса. CD –антигены (кластеры дифференцировки), молекулы поверхности клеток, по которым их маркируют. Эти антигены выявляют с помощью меченых моноклональных антител. Насчитывают около 350 CD- антигенов. Гетероантигены – доноры другого вида. Бактериальные антигены 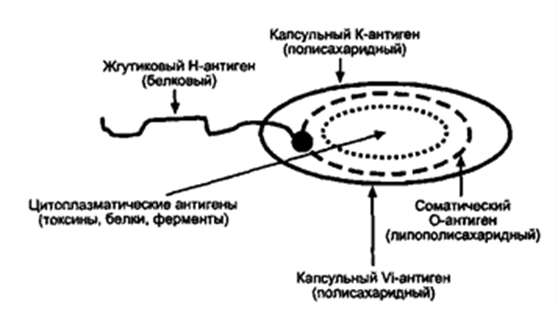 Микробные АГ подразделяют в зависимости от: а) локализации в микробной клетке (поверхностные и глубокие); б) химического строения (гликопротеины, нуклеопротеины, гликоконъюгаты, липоконъюгаты, белковые экзотоксины); в) практического значения (например, протективные АГ, по отношению к которым вырабатываются AT в высокой концентрации). Примерами микробных АГ, наиболее значимых для практики, являются: а) О-антиген (старое название — соматический), представляющий собой Л ПС наружной мембраны гра мотрицательных бактерий; благодаря вариабельности полисахаридных цепей S-полисахарида имеет множество вариантов — антигенных фракций; б) К-антиген (мукополисахаридный белковый конъюгат слизистого слоя бактериальной оболочки), имеющий несколько вариантов. Капсульные антигены (К-антигены) образуют микробы, способные образовывать капсулы. По своему химическому составу К-антигены — полисахариды. К их числу относится Vi- антиген — антиген вирулентности. Он содержится у возбудителей кишечных инфекций, обладающих высокой вирулентностью. Соматические и капсульные антигены имеют большое значение для формирования устойчивости к заражению. Они входят в состав химических вакцин. в) жгутиковые протеины, также имеющие несколько вариантов (фракций); г) конъюгаты клеточных стенок грамположительных бактерий с участием пептидогликана, тейхоевых и липотейхоевых кислот. д) бактериальные белковые экзотоксины: столбнячный, дифтерийный и ботулинический. Микробы, попавшие в организм, продуцируют эти токсины и вызывают развитие интоксикации. После обработки формалином экзотоксины теряют токсичность, но сохраняют иммуногенность (анатоксины). е) Суперантигены — антигены микробов, взаимодействующие с МНС II класса антигенпрезентирующих клеток (АПК) и Т-клеточным рецептором (TCR) Т-лимфоцитов, вне антигенсвязывающей щели, т.е. не в активных центрах. Суперантигены присоединяются как бы сбоку молекул МНС II и TCR, т.е. без предварительной обработки антигенов (процессинга) в АПК. Они стимулируют ложную реакцию распознавания антигена, вызывая поликлональ ную активацию и антигеннеспецифическую пролиферацию лимфоцитов, гиперпродукцию цитокинов, способствующих развитию воспаления, деструкции тканей и гибели Т-лимфоцитов с явлениями иммунодефицита. Суперантигенами являются: энтеротоксины и токсин синдрома токсического шока стафилококков; суперантигены стрептококков, вируса Эпштейна—Барр и др. 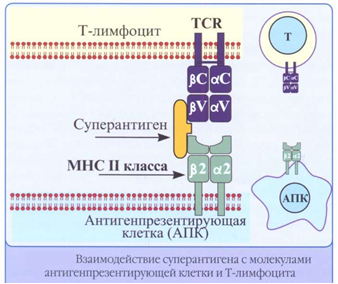 Практическое значение микробных АГ: Из АГ микроорганизмов получают препараты — диагностикумы для определения AT. Используют для получения иммунных диагностических сывороток путем иммунизации животных этими АГ. Используют для получения вакцин для профилактики инфекционных заболеваний. Антигены вирусов Антигены вирусов подразделяют на: а) нуклеопротеидные; б) капсидные; в) суперкапсидные. АНТИТЕЛА Антитела – это белки сыворотки крови (преимущественно глобулиновой фракции), относящиеся к различным классам иммуноглобулинов, способные специфически связываться с антигеном и участвующие во многих иммунологических реакциях. Антитела обладают способностью специфически взаимодействовать с детерминантами антигенов. Например, на рисунке видно, что антитело 1 способно реагировать только с антигенной детерминантой 1, антитело 2-е детерминантой 2, антитело 3-е детерминантой 3, антитело 4 — с детерминантой 4. 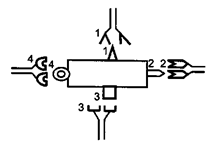 Специфичность иммунитета в большой мере определяется антителами. Человек, переболевший дифтерией, не заболевает этим заболеванием повторно из-за присутствия в его крови антител, способных соединяться и обезвреживать дифтерийный токсин. Однако эти антитела не защищают человека от других заболеваний, например от кори, гриппа или кишечных инфекций. Специфические антитела против дифтерийного токсина, введенные ребенку, создают у него невосприимчивость к заболеванию только дифтерией. В этом проявляется специфичность антител. Функции AT: 1) взаимодействие с соответствующим АГ; 2) фиксация комплемента; 3) лизис клеток; 4) нейтрализация вирусов и токсинов; 5) опсонизация; 6) проникновение через физиологические барьеры. Строение молекулы иммуноглобулина было изучено Портером и Эделманом (Нобелевская премия, 1972), которые показали, что она состоит из двух тяжелых полипептидных цепей (Н-цепей из 440-450 аминокислотных остатков, соединенных дисульфидными связями) и двух легких цепей (L-цепей из 220 аминокислотных остатков), которые соединяются с тяжелыми, также дисульфидными связями. Одна тяжелая и одна легкая цепь формируют элементарное звено молекулы им-муноглобулина. Молекулу иммуноглобулина формирует четное число спаренных звеньев. 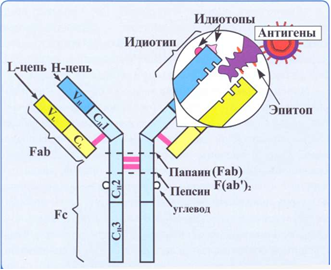 Состав аминокислот в концевых участках L- и Н-цепей вариабельный и определяет специфичность молекулы Ig. Участок L- и Н-цепей связывается с АГ, поэтому называется фрагментом связывания АГ, или Fab. Концевые домены Fab-фрагментов формируют активный центр (паратоп), который состоит из гипервариабельных участков L- и Н-цепей соответственно, строго специфичных определенным эпи топам АГ. Активный центр AT состоит из 15-20 аминокислот и определяет специфичность взаимодействия AT с АГ (другое название активного центра — идиотип, что означает индивидуальность построения его структуры, отличие ее от других активных центров аналогичных AT). Фрагменты полипептидных цепей с постоянным составом аминокислот АГ не связывают. Этот участок называется Fc-фрагментом. Функции Fc-фрагмента: связывает комплемент; активирует фагоцитоз; обеспечивает проникновение через плаценту некоторых иммуноглобулинов; соединяется с рецепторами клеток у цитофильных иммуноглобулинов; участвует в дегрануляции тучных клеток и базофилов. Показателями, характеризующими способность антител реагировать с антигеном, являются аффинность и авидность. Афинность – степень пространственного соответствия структуры антигенсвязывающего центра АТ (паратопа) и антигенной детерминанты АГ (эпитопа). Авидность – сила прочности и интенсивности связывания Аг и АТ. Наибольшим аффинитетом обладают моноклональные антитела, наименьшим — нормальные или естественные антитела. Валентность — это количество активных центров AT, которые способны соединяться с антигенными детерминантами. Характеристика иммуноглобулинов По физико-химическим и биологическим свойствам выделяют классы иммуноглобулинов: G, М, А, Е, D. IgG (70-80%) имеют гамма-тип тяжелой цепи, мономеры, образуются на повторное введение АГ, проходят через плаценту, активируют комплемент по классическому типу, нейтрализуют вирусы и токсины. Обеспечивает местный иммунитет, например кожи, подслизистая полости рта, уха. IgM (5-10%) имеют мю-тип тяжелой цепи, пентамеры, появляются первыми на антигены, тяжелая цепь состоит из пяти доменов (550 аминокислот), не проходят через плаценту, активируют комплемент по классическое типу. Обеспечивает местный иммунитет, например кожи, подслизистая полости рта, уха. IgA (10 %) имеют альфа-тип тяжелой цепи. Встречаются в двух вариантах: сывороточные, - являются мономерами, имеют два антигенсвязывающих центра; - не связывает комплемент; - не проходит через плаценту секреторные, - являются димерами. Секреторные IgA содержатся в различных секретах организма: слюне, слезах, секретах желудочно-кишечного тракта и т.д. Образуются плазматическими клетками, расположенными в подслизистом слое. Проходя через клетки покровного эпителия, мономеры соединяются в димеры и приобретают секреторный компонент. По химической природе — гликопротеин. Он защищает молекулу AT от действия протеаз и желудочного сока. Секреторные IgA - обеспечивают местный иммунитет, т.к. соединяются с рецепторами вирусов и бактерий и препятствуют прикреплению последних к рецепторам слизистых оболочек верхних дыхательных путей, кишечника и т.д; - местный иммунитет коъюнктивы глаза. IgE (меньше 1 %) Имеют эпсилон-тип тяжелой цепи, мономеры. Их называют реагинами. Fc-фрагмент молекулы IgE имеет структуры, ответственные за связь с клеточными Fc-рецепторами базофилов и тучных клеток, что вызывает дегрануляцию этих клеток с выделением гистамина и других медиаторов. Участвуют в аллергических реакциях гиперчувствительности немедленного типа (ГНТ). IgD (меньше 1 %) Имеют дельта-тип тяжелой цепи, мономеры. Они мало изучены. По-видимому, выполняют регулирующую функцию в некоторых иммунологических процессах. Являются рецепторами В-лимфоцитов. Принимают участие в аутоиммунных реакциях. 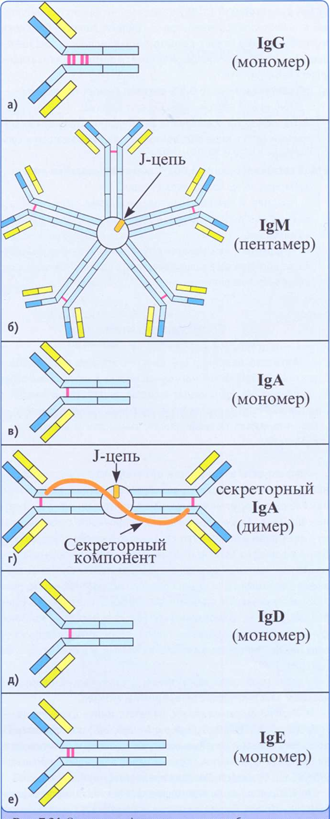 По характеру взаимодействия с антигеном антитела могут быть полными и неполными. Полные антитела имеют два активных центра и проявляют в пробирке свое действие реакциями, видимыми на глаз. Они вырабатываются после иммунизации или перенесенного заболевания. Полные антитела относятся к IgM, IgG и IgA.Неполные антитела имеют один активный центр. Их взаимодействие с антигеном в пробирке не сопровождается видимой на глаз реакцией. Предполагают, что это связано с тем, что другой центр у них блокирован. Неполные антитела относятся к IgA. Иногда антитела вырабатываются без зарегистрированного контакта с чужеродным антигеном. Это естественные или нормальные антитела. Они бывают 2 типов. К I типу относят антитела к изоантигенам, например у людей с кровью группы А в сыворотке присутствуют антитела против эритроцитов с антигеном В, ко II — антитела к микробным антигенам (стафилококку, кишечной палочке, другим микробам). Их синтез происходит, по-видимому, вследствие постоянных контактов организма с микробами нормальной микрофлоры, которые проникают в небольших количествах через слизистые оболочки и фиксируются в регионарных лимфатических узлах, где происходит синтез антител. По своей иммунохимической природе нормальные антитела относятся к IgM. Нормальные антитела постоянно присутствуют в сыворотке крови. Они отражают готовность макроорганизма к реагированию на контакт со многими микробами. Некоторые иммунокомпетентные клетки имеют структурные антитела, которые тесно связаны с мембраной клетки. Структурные антитела имеют ту же специфичность, что и секретируемые антитела. Однако вне связи с клетками они не функционируют. Для проявления их действия необходимы миграция клеток, несущих структурные антитела к патогенному агенту, и непосредственный контакт клеток с антигеном. Все антитела делят на связывающие (IgM, IgG) и не связывающие комплемент (IgA, IgD, IgE). В настоящее время при использовании биотехнологических методов удалось создать принципиально новые искусственные виды антител: одноцепочечные, бифункциональные и иммунотоксины. 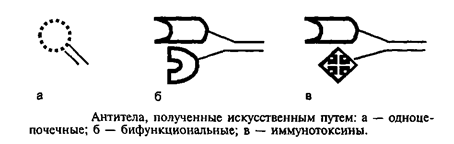 Одноцепочечные антитела представляют собой один активный центр антитела. В связи с малым размером они не обладают иммуногенностью, но способны оказывать защитный эффект при инфекционных заболеваниях. Бифункциональные антитела имеют активные центры разной специфичности и способны связывать два различных типа антигенных детерминант. Иммунотоксины — это гибрид антитела и токсина. Антитело доставляет токсин к клетке-мишени, а токсин убивает ее. Эти виды антител будут использоваться для лечения инфекционных, аллергических и онкологических заболеваний. Иммунный ответ Иммунный ответ можно определить как процесс формирования иммунитета. Иммунитет — состояние организма, характеризующееся наличием: сенсибилизированных лимфоцитов (по отношению к данному АГ); AT к данному АГ; иммунологической памяти. Иммунологическая реактивность — генетически детерминированная способность организма реагировать (отвечать) на внедрение веществ и существ, несущих признаки чужеродной генетической информации. Если сузить понятие этого термина рамками инфекционной иммунологии, то иммунологическая реактивность — это способность к иммунному ответу той или иной степени выраженности и к формированию иммунитета по отношению к конкретному возбудителю. Динамика образования AT и их протективное действие При изучении продукции AT во времени выделяют этапы или фазы иммунного ответа: 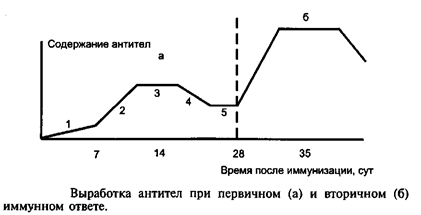 латентный период — это узнавание АГ, которое происходит в результате рецепторного взаимодействия АГ с макрофагом; индуктивный период — это передача информации об АГ Т-лимфоцитам, а затем В-лимфоцитам; продуктивный период — образование AT и поступление их в кровь. В начальной фазе продуктивного периода наблюдается медленное нарастание концентрации IgM (1), а затем IgG (4-5 сут после иммунизации АГ). Затем наблюдается быстрый логарифмический (2) рост количества AT, и их уровень достигает максимума к 10-12-му дню после иммунизации. В конце логарифмического периода через 2—3 нед содержание антител достигает максимально возможного уровня. В течение определенного времени в крови поддерживается постоянный уровень антител (период стабилизации — 3). Максимальный уровень содержания антител в крови сохраняется в течение нескольких дней и сменяется периодом их снижения (4), но оно никогда не достигает нулевого уровня, оставаясь несколько выше его в течение всей жизни организма. Данные периоды характеризуют первичный иммунный ответ. При повторном контакте с АГ происходит вторичный иммунный ответ, который отличается от первичного: синтез AT вызывается меньшими дозами АГ; индуктивный период меньше (5 ч); пик (max) синтеза Ig возникает раньше (5-6-е сутки); аффинитет AT выше; синтезируются главным образом IgG; AT дольше сохраняются в циркуляции; количество AT значительно больше. Перечисленные особенности вторичного иммунного ответа связаны с иммунологической памятью (ИП). Закономерности вторичного иммунного ответа используются в практике специфической профилактики инфекционных болезней для формирования искусственного иммунитета. ). После введения антигена быстрее всех синтезируются IgM (3-й день), потом IgG (5-й день) и IgA (9-й Протективное (защитное) действие ATв организме может проявляться разными путями: Нейтрализация токсической субъединицы экзотоксина (антитоксическое действие). Фиксация на поверхности бактериальной клетки с последующей активацией комплемента, который обеспечивает формирование мембраноатакующего комплекса и лизис бактериальной клетки. Фиксация на поверхности бактериальной клетки и специфическое взаимодействие с рецепторами макрофагов (опсонизация), что активирует фагоцитоз. Иммунологическая память — это способность организма реагировать ускорением и усилением ответа на повторное введение АГ. Носителями ИП могут быть Т- и В-лимфоциты памяти. Моноклональные антитела Моноклональные антитела — это антитела, активные против одной детерминанты антигена. Для получения этих антител необходимо культивировать моноклон клеток, т.е. культуру антителопродуцентов, происходящих из одного лимфоцита. С этой целью используют клетки лимфоидной системы, переродившиеся в онкогенные злокачественные формы (например, плазмоциты). Они возникают из одной клетки и могут длительно поддерживать свою генерацию в пробирках. Соединяя эти клетки (1) с нормальными иммунными лимфоцитами (2), получают гибридомы (3). От лимфоцита гибридомные клетки получают способность синтезировать одно определенное антитело, а от онкогенных клеток — способность к бесконечному размножению. Эта методика позволила получать вне организма неограниченное разнообразие моноклональных антител. С их помощью проанализированы структура и генетика иммуноглобулинов, открыты и исследованы рецепторы лимфоцитов, выделены их субпопуляции. Гибридомные моноклональные антитела используются в качестве высокоспецифических диагностических и лечебных сывороток. Делаются попытки лечения ими злокачественных новообразований. 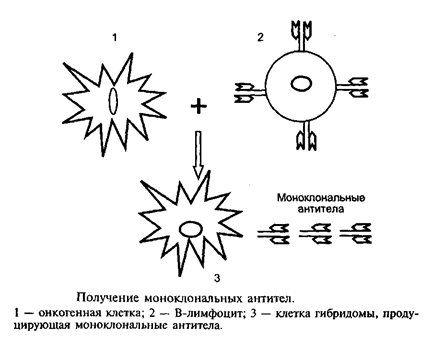 |
