Эксперименттік есептер. 30 Лекция Эксперименттік есептер шығару. Лекция Эксперименттік есептерді шешу
 Скачать 54.59 Kb. Скачать 54.59 Kb.
|
|
Лекция «Эксперименттік есептерді шешу» Экспериментттік тапсырмада – тек тапсырма көрсетіліп, ал эксперименттің жүргізілуі мен жолын оқушылар өздігінен анықтайды. Бұл оқушыларлан тек теорилық білімнің белсенділігін ғана емес , сонымен қоса эксперименттің технологиялық біліктілігін де талап етеді. Экспериментальды тапсырманың негізгі мақсаты- практикада алынған біліммен байланысты жүйелі жаттығуларды орындау, түрлі зерттеулерге қажетті экспериментальды білікітлік пен дағдыны қалыптастыру. Сарамандылық жұмыс пен зертханалық жұмыстан айырмашылығы эспериментальды тапсырманы бүкіл оқу жылы бойы, кез келген сабақтарда, бақылауларда да жүргізуге болады. Экспериментальды тапсырма жеке, топпен немесе сыныппен орындалуы мүмкін. Бұл тапсырманы орындау теориялық шешімді өздігімен ізденуге баулыйды. Құрамы бойынша экспериментальды тапсырмалар келесідей болып бөлінеді: - физикалық және химиялық құбылыстарды бақылауға және түсіндіруге арналған экспериментальды тапсырма. Мысалы, « Қандай физикалық және химиялық қасиетіне қарап полиэтилен мен полистиролды анықтауға болады. берілген ыдыстарда осы заттардың қайсысы орналасқан?» - зат синтезіне және реакцияның жүру ждағдайын алдын ала анықтау немесе түсіндіруге арналған экспериментальды тапсырма. Мысалы, « Столда бар реактивтерден: мыс(//) оксиді , су , мыс(//) хлориді, натрий гидроксиді және нартий хлоридінен екі жолмен мыс(//) гидроксидін алыңдар. әр реакцияның жүру жағдайын көрсетіңдер.» - заттарды тану және олардың өзіне тән қасиеттерін түсіндіруге арналған экспериментальды тапсырма. Мысалы, « сапалық реакция арқылы қай пробиркада крахмал, қай пробиркада глюкоза бар екенін анықтап, олардың химиялық қасиетін түсіндіріңдер» - заттардың сапалық құрамын анықтап, олардың қасиеттерін сипаттауға арналған экспериментальды тапсырма. Мысалы, сапалық реакция арқылы берілген заттың алюминий хлориді екенін анықтап, оның химиялық қасиетін атаңдар. - Берілген өнімдегі қоспаларды анықтап, анықтау жолын түсіндіруге арналған экспериментальды тапсырма. Мысалы, мыс купоросының құрамында натрий хлориді барын анықтаңдар. Оны анықтауға жолдың таңдалу себебін түсіндіріңдер. - Затты таза күйінде қоспалардан бөліп алу, сол бөліп алу әдісінің тиімділігін түсіндір. Мысалы, полиэтлен және темір ұнтақтары бар қоспалардан ас тұзын бөліп алу. - Сапалық реакция жүргізу және оладың типтік қасиеттерін түсіндіру. Мысалы, сапалық реакция көмегімен глюклзаны анықта. Оның типтік химиялық қасиетін атаңдар. - әр түрлі массалық улестегі ерітінділерді дайындау және дайындалу жолын түсіндіруге арналған экспериментальды тапсырма. Мысалы, 3 пайыздық массалық үлесі бар 300 г. натрий гидрокарбонатаның ерітіндісін дайында. Және не үшін ерітінді дайындау кезінде алдымен зат салынып, кейін барып су құйылады. Ал неге керісінше жасауға болмайтындығын түсіндіру. Эспериментальды тапсырмаларды сапалық және есептік эксперимент деп бөліп қарастырады. Сапалық эксперимент тәжірибелік жолмен шешіледі онда сандық бейнелер берілмеген. Мысалы, тәжірибелік жолмен темір сульфатындағы сульфат иондарының мөлшерін анықта. Ал, есептік эксперименттік тапсырмаларды шешу үшін тәжірибе орындаумен қатар белгілі экспериментте берілген мәндерді өңдеу керек. Мысалы, темір (ІІІ) гидроксидінің тұнбасын алып, түзілген тұнба массасы бойынша оны алуға қажетті ерітінді массасын анықта. Бұл жердегі КОН массалық үлесі 0,1н. (10 пайыз). Есептік және эксперименттік тапсырмалардың жоғары формасы екі тапсырманың да ең жақсы қасиеті шоғырланған – есептік эксперимент болып табылады. Химиялық заттарды бір-бірінен ажырата білуге эксперименттік есептер шығару 1.Тұз ерітінділері кұйылған сынауықтардың қайсысында темір(ІІІ) хлориді, мыс(ІІ) хлориді, кальций хлориді бар екенін анықтаңдар. Әр ерітінді құйылған сынауыққа аммоний тиоцианатын тамызамыз. Нәтижесінде қызыл-қан түске өзгерген сынауықта-темір(ІІІ) хлориді, қара түске өзгергені –мыс(ІІ) хлориді ал ешқандай эффект байқалмаған сынауықтағы кальций хлориді FeCl+3NH4CNS=Fe(CNS)3+3NH4Cl қызыл қан тусті CuCl2+2NH4CNS=Cu(CNS)2+2NH4Cl қара түс Немесе: Әр сынауыққа NaOH тамызамыз.Қызыл-қоңыр тұнба түзілген сынауықтағы темір(III) хлориді, қөгілдір түсті тұнба түзілген мыс(II) хлориді ал реакция жүрмей, өзгеріссіз қалған сынауықта- кальций хлориді болған F  eCl3+3NaOH=Fe(OH)3 +3NaCl eCl3+3NaOH=Fe(OH)3 +3NaClқызыл-қоңыр C  uCl2+2NaOH=Cu(OH)2 +2NaCl uCl2+2NaOH=Cu(OH)2 +2NaClкөгілдір СaCl2+NaOH= Түзілген темір(ІІІ) гидроксидін қыздырсақ күрең-қоңыр түсті темір(ІІІ) оксиді, ал мыс(II) гидроксидін қыздырсақ қара түсті мыс(II) оксиді түзіледі  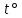 2Fe(OH)3=Fe2O3+3H2O күрең-қоңыр Сu(OH)2=CuO+H2O қара Сульфат-ионына сапалық реакция Бір сынауыққа сұйытылған күкірт қышқылын, екіншісіне натрий сульфатын құйыңдар және әрқайсысына барий хлориді немесе нитраты ерітіндісін қосыңдар. Түзілген тұнбаның құрамы қандай? Реакцияның молекулалық, толық және қысқартылған иондық түрде теңдеуін жазыңдар. SO 42- ионына қандай ион реактив болып табылады? Шешуі: Қажетті реактивтер мен құрал-жабдықтар: сұйытылған күкірт қышқылы, натрий сульфаты, барий хлориді немесе нитраты ерітінділері, сынауықтар. Реакция нәти+жесінде екі сынауықта бірдей, Ba2+ және SO42- иондарынан құрылған ерімейтін ақ тұнба түзіледі.
Бірінші сынауықта: H2SO4+BaCl2=BaSO4 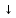 +2HCl молекулалық теңдеу +2HCl молекулалық теңдеу SO42-+Ba2+=BaSO4 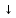 қысқартылған иондық теңдеу қысқартылған иондық теңдеу  Екінші сынауықта: Екінші сынауықта: NaSO4+BaCl2=BaSO4 +2NaCl молекулалық теңдеу NaSO4+BaCl2=BaSO4 +2NaCl молекулалық теңдеуSO42-+Ba2+=BaSO4 қысқартылған иондық теңдеу Демек, SO42-+Ba2+ катионы реактив болып табылады. Нитрат- ионына сапалық реакция Сынауыққа 0,5г натрий нитратын (немесе басқа нитратты) салып, тұзды толығымен жабатындай етіп концентрлі күкірт қышқылының ерітіндісін құйыңдар, содан кейін біраз мыс ұнтағын қосып қыздырыңдар. Қандай газ бөлінеді? Сынауықтағы ерітінді неге көгереді? Реакция теңдеуін жазып, электронды баланс әдісімен коэффициенттерін қойыңдар. Тотықтырғыш пен тотықсыздандырғышты көрсетіңдер. Шешуі: Қажетті реактивтер мен құрал-жабдықтар: құрғақ натрий нитраты, концентрлі күкірт қышқылы, мыс ұнтағы, сынауықтар, таразы, қалақша. Реакция нәтижесінде қоңыр-қошқыл газ бөлінеді. Сынауықта көк түсті мыс(ІІ) сульфаты түзіледі: 2NaNO3+4H2SO4+3Cu=3CuSO4+2NO 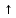 +4H2O+Na2SO4 +4H2O+Na2SO42NO3-+8H++3Cu=3Cu2++4H2O+2NO 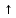 2NO 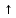 +O2=2NO2 +O2=2NO2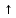 Демек, 2NaNO3+2H2SO4+Cu=CuSO4+2NO2 +2H2O+Na2SO4 Осы теңдеуді электрондық баланс әдісімен теңестірсек: +5 0 +2 +4 2NaNO3+2H2SO4+Cu=CuSO4+2NO2 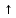 +2H2O+Na2SO4 +2H2O+Na2SO4Тотықсыздану N+5+1ê=N+4 2 Тотығу Cu0-2ê=C+2 1 2N+5+Cu0=N+4+Cu2+ Бұдан көрініп тұрғандай, азот (нитрат ионы)- тотықтырғыш,ал мыс-тотықсыздандырғыш. Осы теңдеуді электрондық-иондық әдіспен теңестірер болсақ: NO3-+2H++ ê=NO2 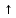 +H2O 2 +H2O 2Cu0-2ê=Cu2+ 1 Яғни, 2NO3-+4H++Cu0=2NO2 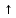 +2H2O+Cu2+ +2H2O+Cu2+3-есеп. Лакмуспен аммоний нитраты, натрий карбонаты және калий хлориді ерітінділерін сынаңдар және байқалған өзгерісті түсіндіріңдер. Шешуі: Қажетті реактивтер мен құрал-жабдықтар: аммоний нитраты, натрий карбонаты және калий хлориді ерітінділері, лакмус қағазы не ерітіндісі сынауықтар. Заттар ерігенде су молекулаларымен алмасу реакциясына түсіп, гидролизге ұшырайды. Аммоний нитраты сулы ерітіндісіне лакмус қағазы қызыл түске боялады. Бұдан гидролиз нәтижесінде түзілген орта қышқылдық болатынына көз жеткізуге болады. Гидролиз процесінің молекулалық және иондық теңдеулері:   NH4NO3+HOH NH4OH+HNO3(орта қышқылдық) NH4NO3+HOH NH4OH+HNO3(орта қышқылдық) NH4++HOH NH4OH+H+ NH4++HOH NH4OH+H+Ал, натрий карбонатының гидролизі екі сатыда жүреді. І саты:  Na2CO3+HOH Na2CO3+HOH 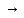 NaOH+CO2 +H2O NaOH+CO2 +H2O  CO32-+HOH CO32-+HOH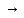 HCO3-+OH- HCO3-+OH-І  І саты: І саты:N   aHCO3+HOH NaOH+CO2 + H2O aHCO3+HOH NaOH+CO2 + H2O  HCO3-+ HOH H2O+CO + OH- орта негіздік HCO3-+ HOH H2O+CO + OH- орта негіздікНегіздік ортада лакмус қағазы көк түске боялады. Ал, калий хлориді KCl гидролизге ұшырамайды, себебі ол күшті негіз бен күшті қышқылдың тұзы. Орта бейтарап болғандықтан лакмус қағазы күлгін түске боялады. №4. Ыдыста А жай затының 0,18г үлгісін концентрлі күкірт қышқылының артық мөлшерімен қыздырады. Реакцияның газтәрізді өнімдерін кальций гидроксидінің артық мөлшері арқылы өткізген кезде 5,1 г тұнба түзіледі. А затын анықтаңыздар және жауабыңызды сәйкес реакция теңдеулері және есептеулермен дәлелдеңіздер. Шешуі: Ізбес суымен тұнбаны концентрлі күкірт қышқылының активтілігі аз металдарға немесе бейметалдарға әсерінің нәтижесінде бөлінетін күкірт (IV)оксиді түзуі мүмкін:  Ca(OH)2+SO2=CaSO3 + H2O; Ca(OH)2+SO2=CaSO3 + H2O;Активті металдармен концентрлі күкірт қышқылы әрекеттескен кезде күкіртсутек бөлінуі мүмкін, бірақ × x(CaSO3)=5,1/120=0,0425 моль. Бір валентті металл үшін реакция теңдеуі:  2A+2H2SO4=A2SO4+SO2 +2H2O. 2A+2H2SO4=A2SO4+SO2 +2H2O.Осы теңдеуден А металының молярлы массасын есептейік: 0,18/(0,0425×2)=2,12 г/моль. Екі-, үш-, төртвалентті металдар үшін сәйкесінше алынған мәліметтер: 4,24,6,36,8,48г/моль. Осы молярлық массаларға сәйкес металдар жоқ, яғни А-бейметалл. Оның күкірт қышқылымен тотығу реакциясының өнімі-ізбес суымен тұнба түзетін газ. А заты- күкірт немесе көміртек болуы мүмкін: Күкірт үшін реакция теңдеуі: S+2H2SO4=3SO2+2H2O; x(S)=0,18/32=0.056моль; x(SO2)=0,056×3=0,0168 моль; m(CaSO3)=0,0168×120=2,04г, бұл 5,1г кем. Көміртек үшін реакция теңдеуі: C+2H2SO4=CO2+SO2+2H2O; x(CaCO3)=0,015×100=1,5г; x(CaSO3)=x(SO2)=0,03 моль; m(CaSO3)=0,03×120=3,06г. Тұнбалардың жалпы массасы: 1,5+3,6= 5,1г. Бұл есеп шартына сәйкес. Сонымен, А заты-көміртек. |
