Химичка дура. 3. Физические величины, характеризующие вещество. Законы химии (. Лекция Физические величины, характеризующие вещество. Законы химии
 Скачать 220 Kb. Скачать 220 Kb.
|
|
ЛЕКЦИЯ «Физические величины, характеризующие вещество. Законы химии» План: Физические величины, характеризующие вещество. Основные законы химии: – закон сохранения массы вещества – закон сохранение энергии – закон постоянства свойства – закон Авогадро – закон эквивалентов 1. Физические величины, характеризующие вещество Размеры атомов Атомы различных элементов имеют разные размеры и разные массы. Массы атомов очень малы, но современные методы исследования позволяют определять их с большой точностью. Так: mат.(Н) = 1,674∙10-27 кг mат.(О) = 2,667∙10-26 кг mат.(С) = 1,993∙10-26 кг Массы атомов, которые выражены в обычных единицах массы (кг или г), называют – абсолютными атомными массами (ma). Использовать такие малые величины неудобно. Поэтому в химии обычно используются относительные атомные массы. За единицу атомных масс принимается 1/12 часть абсолютной массы атома изотопа углерода 12С. 1 а.е.м. = Относительная атомная масса элемента Ar – это величина, равная отношению массы атома элемента к 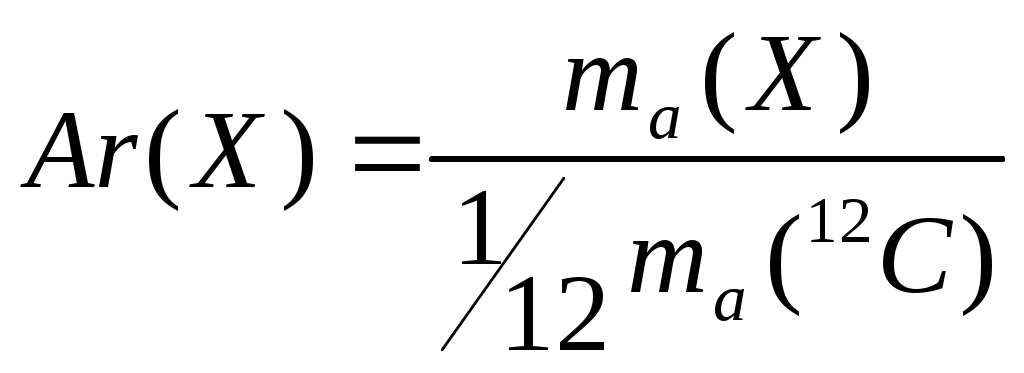  Относительная молекулярная масса Mr – это отношение массы молекулы вещества к 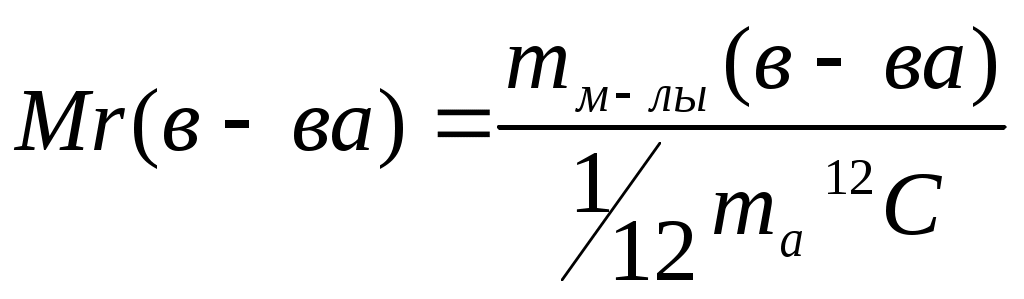 – равна сумме относительных атомных масс элементов, входящих в состав молекулы с учетом количества атомов каждого элемента. Mr(H2O) = 2Ar(H) + Ar(O) = 2∙1 +16 = 18 В международной системе единиц за единицу измерения количества вещества принят моль – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов и т. д.), сколько содержится атомов в 12 г изотопа углерода 12С. Определим число атомов 12С в 12 г: NA – число Авогадро => 1 моль любого вещества содержит 6,02∙1023 частиц NA-показывает число структурных единиц в моле любого вещества. Количество вещества (ню) – т. е. число молей, равно отношению данного числа частиц (атомов, молекул, ионов) N к NА Задача: Определить, сколько молей составляет 12,04∙1023 молекул CO2. 1 моль CO2 – 6,02∙1023 молекул СО2 х моль CO2 – 12,04∙1023 молекул СO2 или: 2) Ответ: 2 моль. Молярная масса M(H2SO4) = 2∙1+ 32+ 4∙16 = 98 M – величина, связывающая массу и количество вещества Задача: Какое количество вещества и сколько атомов содержится в 14 г железа? Д  ано: Решение: ано: Решение:m(Fe) = 14 г 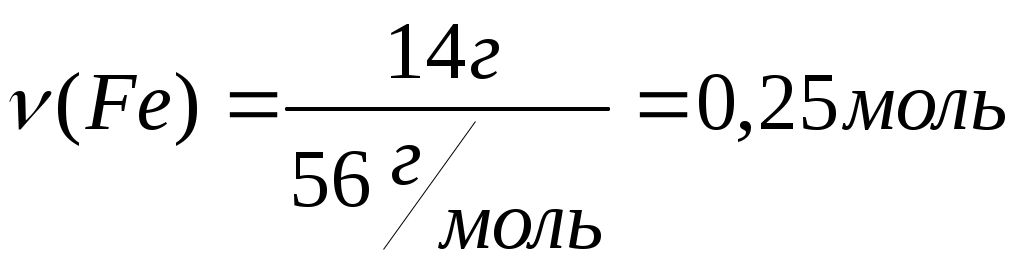 Ответ: 14 г железа содержит 0,25 моль железа и 1,5∙1023 атомов железа. Молярный объем газа Vm ( При нормальных условиях 1 моль газа занимает объем, равный 22,4 л. Молярный объем любого газа при н.у. равен 22,4 Нормальные условия: T = 0oC или 273 К P = 1 атм. = 760 мм.рт.ст. = 101,3 кПа – зная молярный объем газа (Vm), можно рассчитать объем (V) любого количества () и любой массы (m) газа: Задача: Вычислить массу 56 л водорода (н.у.). Д  ано: Решение: ано: Решение:V  (H2)= 56 л (H2)= 56 л m(H2) – ? M(H2) = 2 m(H2) = 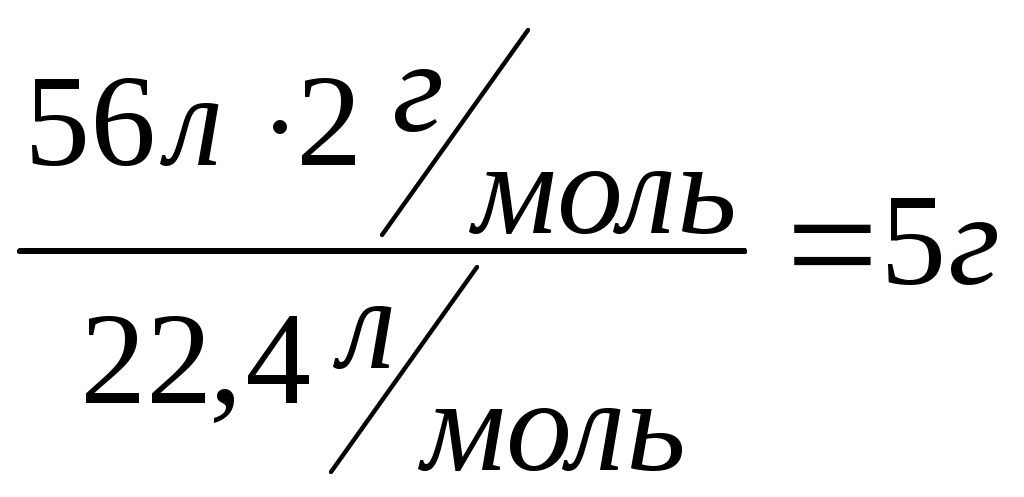 Ответ: 5 г. Относительная плотность газа Д = – величина безразмерная, показывает во сколько раз один газ тяжелее другого. Часто плотности различных газов определяют по отношению к водороду (самый легкий из газов) и по отношению к воздуху: – относительная плотность любого газа по водороду: – относительная плотность по воздуху: Задача: Плотность этилена по кислороду равна 0,875. Определить молярную массу этилена. Дано: Решение:  =0,875 =0,875 М(этилена)-? Ответ: Массовая доля элемента в соединении Задача: Рассчитать массовую долю (%) алюминия в оксиде алюминия. Al2O3 – оксид алюминия Ответ: Основное уравнение газового состояния В расчетах, связанных с газами, часто приходится переходить от данных условий к нормальным или наоборот. При этом пользуются уравнением объединенного закона (Клапейрон): P, V, T – при данных условиях P0, V0, T0 – при нормальных условиях Уравнение Клапейрона-Менделеева Для 1 моля газообразного вещества Уравнение Клапейрона будет иметь вид Менделеев предложил уравнение для молей газа Задача: Определить массу 1 м3 азота при температуре 200С и давлении 3 атм. Д  ано: Решение: ано: Решение: 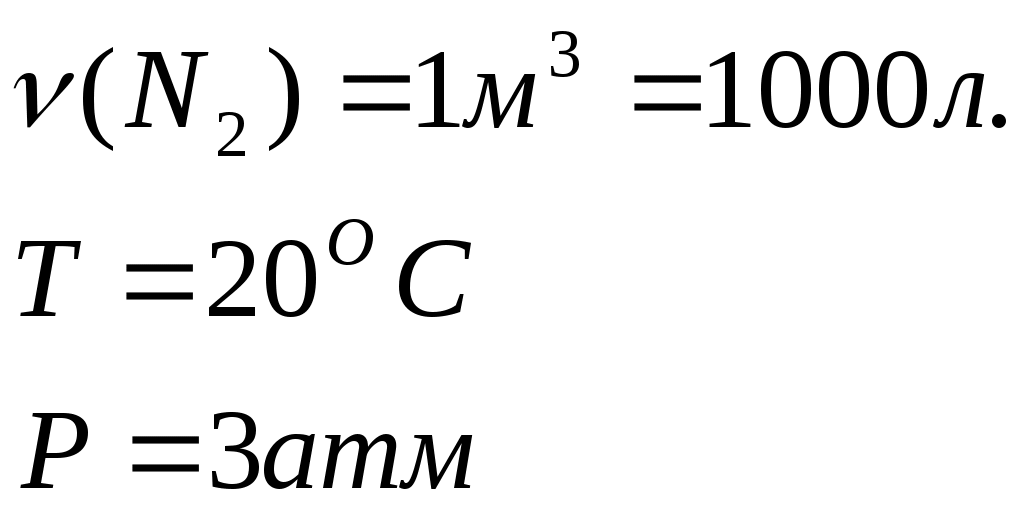 m(N2)-? M(N2) = 28 г ∕ моль; R = 0,082л·атм/моль·К Т = 200 + 273 = 293 К 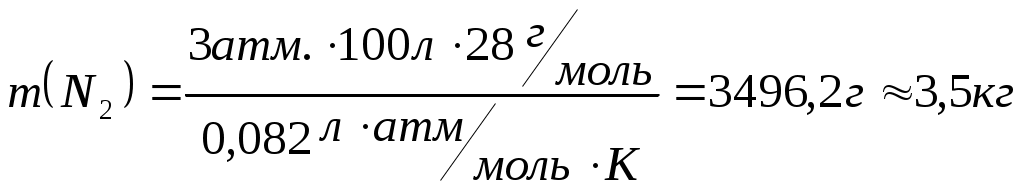 Ответ: m(N2) ≈ 3,5 кг. Химические элементы взаимодействуют друг с другом в строго определяют количествах отношениях. Химический эквивалент – это реальная или условная частица, которая в реакциях кислотно-основного обмена соответствует 1 катиону водорода, а в ОВР 1 принятому или отданному е. Эквивалентная масса элемента – это масса одного эквивалента элемента. Эквивалентная масса кислоты: е сли по реакции: Задача: Определить эквивалентную массу фосфорной кислоты в реакции: H3PO4 + NaOH → NaH2PO4 + H2O; Эквивалентная масса основания: если по реакции: Al(OH)3 + HCl → Al(OH)2Cl + H2O Эквивалентная масса соли: если по реакции: Na2CO3 + HCl → NaHCO3 + NaCl Эквивалентная масса оксида: если по реакции CO2 + 2NaOH = Na2CO3 + H2O; Эквивалентная масса окислителя: Эквивалентная масса восстановителя: Основные законы химии Закон сохранения массы веществ – масса веществ вступивших в реакцию равна массе веществ образовавшихся в результате реакции. На основании этого закона при написании уравнений химической реакции с помощью коэффициентов перед молекулярными формулами необходимо слева и справа уравнять число атомов каждого элемента. Пример: 2KClO3 = 2KCl + 3O2 Слева: 2 атома калия, 2 хлора, 6 кислорода. Справа: 2 атома калия, 2 хлора, 6 кислорода. В 1748г. М.В.Ломоносов и в 1789г. А.Лавуазье независимо друг от друга открыли закон. – закон не является абсолютным, что подтверждается уравнением Энштейна: Е = mс2 (с – V света в вакууме) – из уравнения следует, что если реакция идет с выделением энергии (тепла), то масса после реакции будет меньше, а если с поглощением энергии, то больше. Но разница очень мала и при расчетах не учитывается. Закон сохранения энергии (М.В. Ломоносов) – энергия не возникает из ничего и не исчезает бесследно, она переходит из одного вида в другой в строго эквивалентных количествах. Закон постоянства состава (Ж.Пруст 1808г.) – всякое чистое вещество независимо от способа получения имеет постоянный количественный и качественный состав: CaCO3 → CaO + CO2 C + O2 → CO2 Следствие: все вещества реагируют между собой в строго определенных количественных соотношениях. – закон справедлив только для веществ с молекулярной структурой постоянного свойства (дальтониды); – состав соединений с немолекулярной структурой зависит от условий получения (бертоллиды) (TiO; TiO0,7 – TiO1,.3). Закон Авогадро – в равных объемах различных газов при одинаковых условиях (Т, Р) содержится одинаковое число молекул Следствие: 1. 1 моль любого газа при н.у. занимает V = 22,4л 2. В 22,4 л любого газа при н.у. содержится Закон эквивалентов – все вещества реагируют между собой в строго определенных количествах, пропорциональных их эквивалентам: 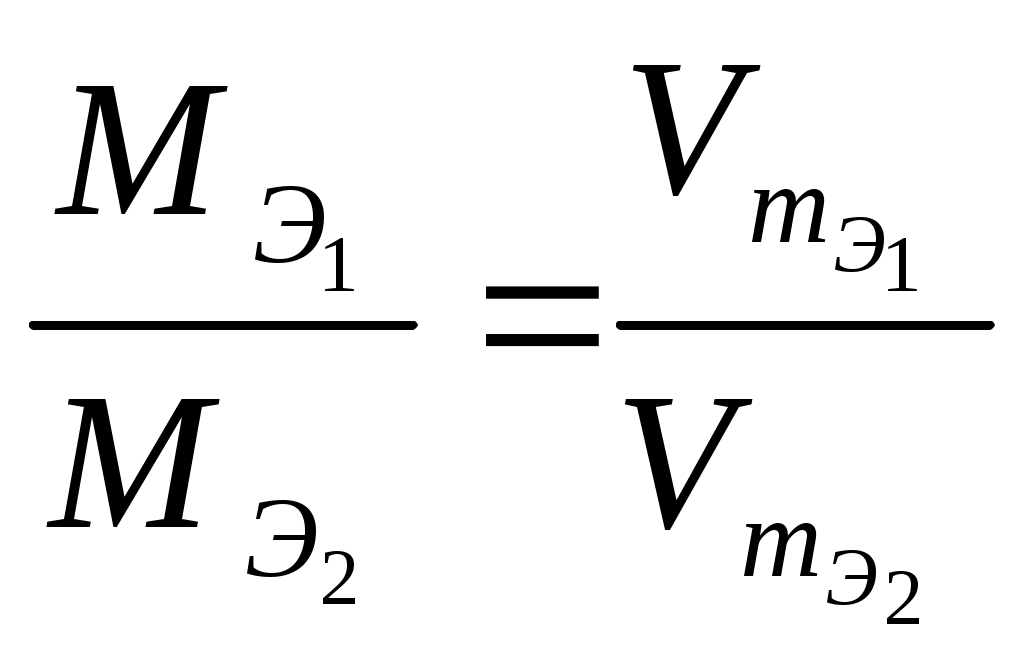 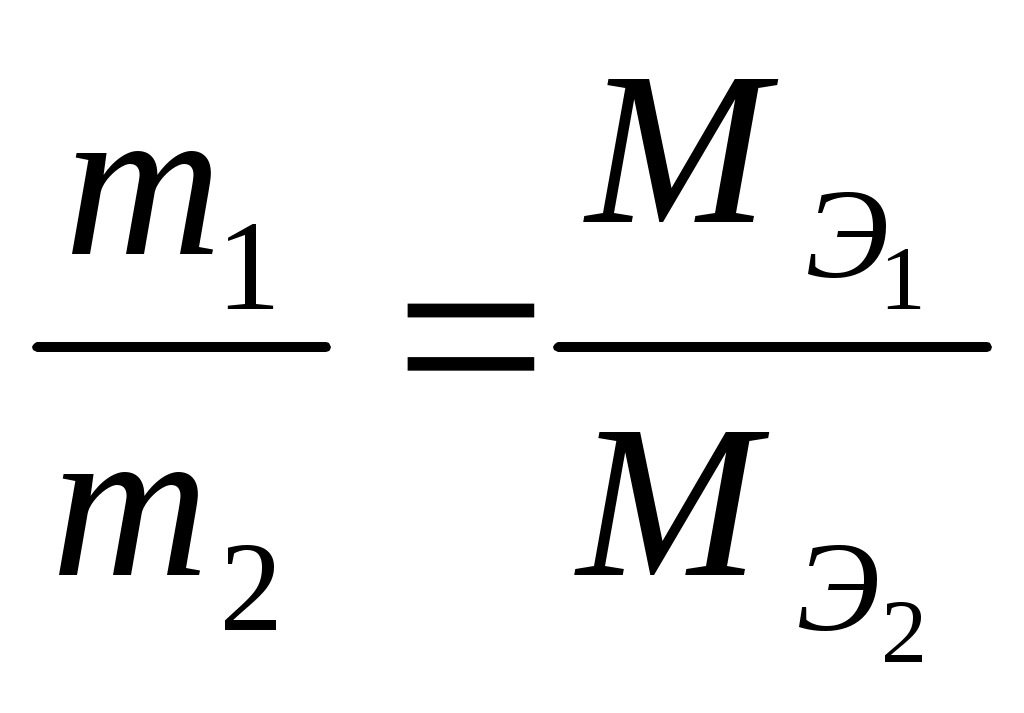 |
