Неметаллы. лекция3 неметаллы. Лекция Неметаллы Общая характеристика элементовнеметаллов
 Скачать 385.27 Kb. Скачать 385.27 Kb.
|
|
Лекция 3. Неметаллы 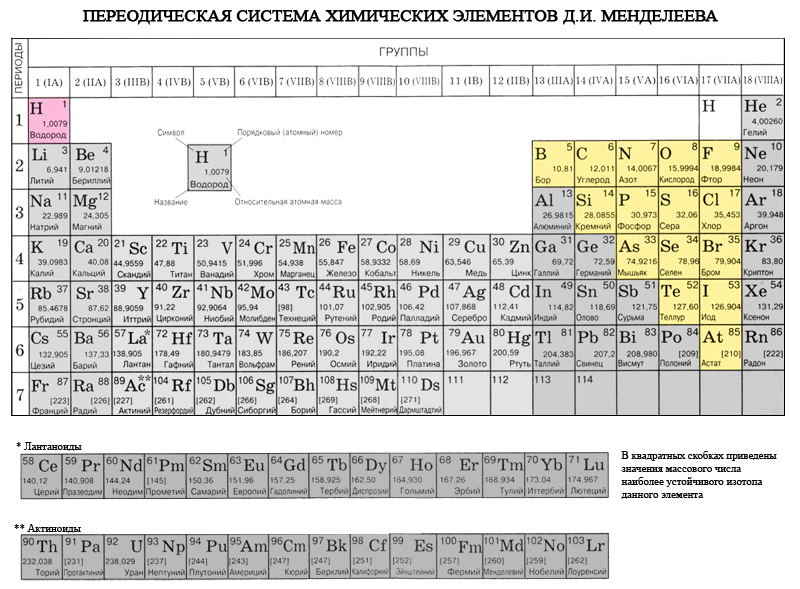 1. Общая характеристика элементов-неметаллов Химических элементов-неметаллов всего 16, но два из них, кислород и кремний составляют 76% от массы земной коры. Неметаллы составляют 98,5 % от массы растений и 97,6 % от массы человека. Из углерода, водорода, кислорода, серы, фосфора и азота состоят все важнейшие органические вещества, они являются элементами жизни. Водород и гелий – основные элементы Вселенной из них состоят все космические объекты, включая наше Солнце. Без соединений неметаллов невозможно представить нашу жизнь, особенно если вспомнить, что жизненно важное химическое соединение – вода – состоит из водорода и кислорода. Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7, для них характерны высокие значения электроотрицательности и окислительные свойства. 1.1. Положение элементов-неметаллов в Периодической системе химических элементов Менделеева Если в Периодической системе провести диагональ от бора к астату, то справа вверх по диагонали будут находиться элементы-неметаллы, а слева снизу – металлы, к ним же относятся элементы всех побочных подгрупп, лантаноиды и актиноиды. Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма, обладают двойственным характером и относятся к металлоидам. Элементы-неметаллы: s-элемент – водород; р-элементы 13 группы – бор; 14 группы – углерод и кремний; 15 группы – азот, фосфор и мышьяк, 16 группы – кислород, сера, селен и теллур и все элементы 17 группы – фтор, хлор, бром, йод и астат. Элементы 18 группы – инертные газы, занимают особое положение, они имеют полностью завершенный внешний электронный слой и занимают промежуточное положение между металлами и неметаллами. Их иногда относят к неметаллам, но формально, по физическим признакам. 1.2. Электронное строение элементов-неметаллов Практически все элементы-неметаллы на внешнем энергетическом уровне имеют большое число электронов – от 4 до 7. Элемент бор – аналог алюминия, у него всего 3 электрона на внешнем энергетическом уровне, но он имеет малый радиус, прочно удерживает свои электроны и имеет свойства неметалла. Особо отметим электронное строение водорода. Это s-элемент, но он довольно легко принимает один электрон, образует гидрид-ион и проявляет окислительные свойства металла. Электронные конфигурации валентных электронов элементов-неметаллов приведены в таблице:
1.3. Закономерности в изменении свойств элементов-неметаллов Рассмотрим некоторые закономерности в изменении свойств элементов-неметаллов, принадлежащих одному периоду и одной группе на основании строения их атомов. 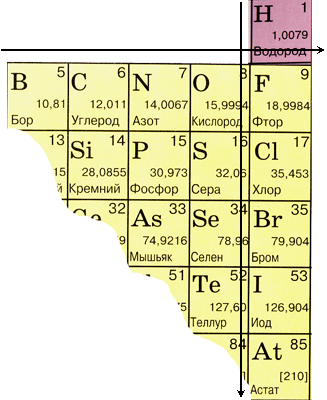 В периоде: - заряд ядра увеличивается, - радиус атома уменьшается, - число электронов на внешнем энергетическом уровне увеличивается, - электроотрицательность увеличивается, - окислительные свойства усиливаются, - неметаллические свойства усиливаются. В группе: - заряд ядра увеличивается, - радиус атома увеличивается, - число электронов на внешнем энергетическом уровне не изменяется, - электроотрицательность уменьшается, - окислительные свойства ослабевают, - неметаллические свойства ослабевают. Таким образом, чем правее и выше стоит элемент в Периодической системе, тем ярче выражены его неметаллические свойства. 1.4. Физические свойства неметаллов Если большинство элементов-металлов не окрашены, исключение составляют только медь и золото, то практически все неметаллы имеют свой цвет: фтор – оранжево-желтый, хлор – зеленовато-желтый, бром – кирпично-красный, йод – фиолетовый, сера – желтая, фосфор может быть белым, красным и черным, а жидкий кислород – голубой. Все неметаллы не проводят тепло и электрический ток, поскольку у них нет свободных носителей заряда – электронов, все они использованы для образования химических связей. Кристаллы неметаллов непластичные и хрупкие, так как любая деформация приводит к разрушению химических связей. Большинство из неметаллов не имеют металлического блеска. Физические свойства неметаллов разнообразны и обусловлены разным типом кристаллических решеток. 1.4.1 Аллотропия АЛЛОТРОПИЯ – существование химических элементов в двух или более молекулярных либо кристаллических формах. Например, аллотропами являются обычный кислород O2 и озон O3; в этом случае аллотропия обусловлена образованием молекул с разным числом атомов. Чаще всего аллотропия связана с образованием кристаллов различных модификаций. Углерод существует в двух четко различающихся кристаллических аллотропных формах: в виде алмаза и графита. Раньше полагали, что т.н. аморфные формы углерода, древесный уголь и сажа, – тоже его аллотропные модификации, но оказалось, что они имеют такое же кристаллическое строение, что и графит. Сера встречается в двух кристаллических модификациях: ромбической (a-S) и моноклинной (b-S); известны по крайней мере три ее некристаллические формы: l-S, m-S и фиолетовая. Для фосфора хорошо изучены белая и красная модификации, описан также черный фосфор; при температуре ниже –77°С существует еще одна разновидность белого фосфора. Обнаружены аллотропные модификации As, Sn, Sb, Se, а при высоких температурах – железа и многих других элементов. 1.5. Химические свойства неметаллов Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие. Атомы самого электроотрицательного элемента – фтора – не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод. Взаимодействие с простыми веществами Взаимодействие с металлами: 2Na + Cl2 = 2NaCl, Fe + S = FeS, 6Li + N2 = 2Li3N, 2Ca + O2 = 2CaO в этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы. Взаимодействие с другими неметаллами: - взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды: 3H2 + N2 = 2NH3, H2 + Br2 = 2HBr; - взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства: S + O2 = SO2, 4P + 5O2 = 2P2O5; - при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем: 2F2 + O2 = 2OF2; - неметаллы взаимодействуют между собой, более электроотрицательный металл играет роль окислителя, менее электроотрицательный – роль восстановителя: S + 3F2 = SF6, C + 2Cl2 = CCl4. Примеры решения задач Задача 1. Запишите уравнения окислительно-восстановительных реакций с участием неметаллов, укажите окислитель и восстановитель: а) Cl2 + H2O б) C + 2H2SO4 (конц.) Решение: А) При взаимодействии хлора с водой образуются хлороводородная и хлорноватистая кислоты: Cl20 + H2O = HCl- + HCl+O. Эта реакции является реакцией диспропорционирования, где хлор одновременно является окислителем и восстановителем. Запишем полуреакции: Cl2 + 2 Cl2 + 2H2O - 2 Б) При взаимодействии углерода с концентрированной серной кислотой образуются оксид углерода (IV), оксид серы (IV) и вода: C0 + 2H2S+6O4 = C+4O2 + 2S+4O2 + 2H2O. Углерод изменяет степень окисления от 0 до +4, а сера – от +6 до +4, полуреакции имеют вид: SO42- + 4H+ + 2 C0 + 2H2O - 4 Задача 2. При взаимодействии серы с концентрированной азотной кислотой (w (HNO3) = 60 %, плотность раствора 1,27 г/мл) образовались серная кислота и оксид азота (II) объемом 67,2 л (н. у.). Вычислите массу серы и объем раствора азотной кислоты, вступивших во взаимодействие. Дано: ω (HNO3) = 60 % ρ (р-ра) = 1,27 г/мл V (NO) = 67,2 л (н. у.) М (S) = 32 г/моль М (HNO3) = 63 г/моль Найти: m (S) V (р-ра HNO3) Решение: Запишем уравнение реакции взаимодействия серы с концентрированной азотной кислотой; по условию задачи образуется оксид азота (II) и серная кислота: S + 2HNO3 = 2NO + H2SO4. Для определения массы серы и объема азотной кислоты, взятой для окисления серы, необходимо знать количество вещества (в моль) образовавшегося оксида азота (II). Для расчета количества газа используем понятие молярный объем: при нормальных условиях 1 моль любого газа занимает объем, равный 22,4 л. Тогда: где n – количество вещества, моль; V – объем газа при нормальных условия, л; Vm – молярный объем газа, равный при нормальных условиях 22,4 л. Вычислим массу серы, необходимую для взаимодействия. По уравнению химической реакции из 1 моль серы образуется 2 моль оксида азота (II), то есть соотношение n(S) : n(NO) = 1 : 2. тогда для образования 3 моль оксида азота (II) необходимо 1,5 моль серы. Количество вещества связано с массой вещества соотношением: где n – количество вещества, моль; m – масса вещества, г; М – молярная масса вещества, г/моль. Тогда масса серы равна: m (S) = n (S) · M (S) = 1,5 · 32 = 48 (г). Для расчета объема азотной кислоты необходимо знать её количество. По уравнению реакции для образования 2 моль оксида азота (II) необходимо 2 моль азотной кислоты, то есть соотношениеn(NO) : n(HNO3) = 1 : 1. По условию задачи образовалось 3 моль оксида азота (II), следовательно, азотной кислоты прореагировало 3 моль. Определим массу азотной кислоты: m (HNO3) = n · M = 3 · 63 = 189 (г). Вычислим массу раствора азотной кислоты, зная массовую долю HNO3 в растворе. По определению: Определим объем раствора 60 %-ной азотной кислоты, необходимый для взаимодействия: Ответ: V(р-ра HNO3) = 229,9 мл; m(S) = 48 г. Задачи для самостоятельного решения 1. Запишите уравнения окислительно-восстановительных реакций с участием неметаллов, укажите окислитель и восстановитель: а) Cl2 + NaOH б) S + NaOH в) C + HNO3 г) O2 + F2 2. Запишите уравнения реакций, при помощи которых можно осуществить следующие превращения: С → СО → СО2 → NaHCO3 → Na2CO3 → CO2. 3. При взаимодействии фосфора с концентрированной азотной кислотой (ω = 60 %, плотность раствора 1,37 г/мл) образовались ортофосфорная кислота и оксид азота (II) объемом 11,2 л (н.у.). Вычислите массу фосфора и объем раствора азотной кислоты, вступивших во взаимодействие. Ответ: V(р-ра) = 38,3 мл; m(Р) = 9,3 г. |
