Обзор бензоатов переходных металлов. Лит обзор бензоаты переходных металлов. Литературный обзор
 Скачать 70.73 Kb. Скачать 70.73 Kb.
|
1 2 Существует огромное множество методов по отчистке вод от фенолов. Их можно разделить на два типа: регенеративные и деструктивные. Регенеративные – методы при которые не предполагают разрушение фенола, то есть, после его выделения его можно переработать или вернуть в производство. Деструктивные же предполагают разрушение фенолов, что позволяет получить менее токсичные соединения. По экономическим соображениям, считается разумным регенерация фенолов их сточных вод, если концентрация, непосредственно, фенола превышает 2 г/л, но регенерационные методы, на практике, применяются и при более низких концентрациях [8]. Наиболее распространёнными методами, для решения задачи по регенерационной очистке сточных вод, являются: экстракция, выпаривание, сорбция. Метод многоступенчатой экстракции, где экстрагентами могут являться, например, бензол или бутил ацетат, достигают изъятие фенолов на 90 - 95%, остаточная концентрация, при таком походе, получается 200-300 мг/л. Такие результаты характерны для шести ступенчатой экстракции, при подаче в ступень 10% экстрагента. Если число ступеней увеличить и, так же, увеличить удельный расход экстрагента, то можно получить на выходе, концентрацию 15-20 мг/л. Вместе с отчищенной водой от 100 до 300 мг/л уйдет и экстрагента, но его, в дальнейшем, достаточно просто отогнать. Фенолы, которые растворились в экстрагенте легко извлечь с помощью каустика. На выпарных установках ежегодно очищается свыше 10 млн. м3 фенолсодержащих сточных вод. При таком методе эффективность составляет 90–93%, а остаточные концентрации – 200 мг/л. Очистку загрязненного фенолами пара производят в скрубберах, где происходит из орошение раствором щелочи. Фенолят, которые образуется в результате, поступает на переработку. Именно этот метод является основным для подавляющего большинства коксохимических производств. Существенным недостатком вышеописанных методов является тот факт, что подобная отчистка не может считаться достаточной, так как, концентрация фенолов в растворе после очистки превышает ПДК. Следовательно, необходима существенная доочистка. Сорбционный метод является более эффективным. В качестве сорбента может выступать активированный уголь, шлаки или, например, генераторная пыль. Активированный уголь способен на 1 кг задерживать 20–30 г фенолов. С помощью такого метода можно получать воду, которая практически не содержит фенолов. Но у данного метода существуют очень существенный недостатки: срок службы активированного угля крайне непродолжительный, а извлечение фенола и регенерация угля, представляются, как крайне трудоемкие и сложные задачи. Необходимо промывать загрузку бензолом или другим растворителем фенолов, с последующем извлечением их из растворителя известью или отгонкой. Можно регенерировать загрузку пропариванием с извлечением фенола из пара с щелочью. Этот метод крайне дорог, и, как следствие, крайне редко применяется. Если задачей является не очистка, а доочистка, до целесообразным является метод сорбции фенола на золе или шлаке. Но сорбционная способность золы крайне различается, в зависимости от происхождения, например, торфяная зола способна сорбировать 1 г фенола на 1 кг собственной массы, а зола бурого угля, всего 160 мг/кг. Если концентрация фенолов невысока, и их выделение не выгодно, то логичным становятся деструктивные методы, как биологического, так и химического окисления. Далее следует рассмотреть деструктивные методы, например биологическую очистку или электрохимическое окисление. Биологическую очистку вод от фенолов могут проводить в аэротенках. Такие сооружения биологическое очистки рассчитываются на очистку бытовых сточных вод или смесей бытовых вод с промышленными водами. Но концентрация фенолов не должна превышать 50 мг/л. Очистка на аэротенках возможна для концентраций до 1200 мг/л. Если же концентрация выше, то такие воды разбавляют технической водой или бытовыми сточными водами. Окислительная способность составляет 1000 г/сутки на 1 м3 объема [9]. Суть метода в применении растения эйхорнии. Эйхорния, так же известная как водяной гиацинт, это водное растения, принадлежащая к виду Эйхорния семейства понтедериевые [10]. Эйхорния ускоряет процессы разложения и детоксикации органических ядов. Достигается такой эффект за счет того она выделяет корневую систему стимуляторов и ингибиторов углеродоокисляющих бактерия. Так же она способна к накоплению тяжелых металлов и радионуклидов [11]. Электрохимические способы наиболее перспективны для очистки от органических примесей различного состава, так как при этом, не изменяется солевой состав очищенной воды, осадок или не образуется или его образуется очень немного. Установки высоко производительны, работа на них автоматизирована. Известные электрохимические методы можно разделить на метод прямого окисления, или окисления на аноде, и метод непрямого окисления (окисления перекисью водорода и активными формами кислорода (ОН• , НО2• , НО2-), синтизируемые сразу на катоде). Так же существует комбинированный метод. Интересе к электрохимическим метода окислительной обработки сточных вод, содержащих токсичные или бионеутелизируемые органические экополлютанты, самым распространённым среди которых является фенол, постоянно возрастает. Окисление происходит в мягких условиях, нет необходимости в повышенном давлении, легко поддается контрою, а регулируется за счет изменения силы тока. Но, при прямом анодном окислении на поверхности электрода образуются полимеризующиеся продукты окисления, блокирующие его поверхность за счет абсорбции. Существует множество методов электрохимического окисления фенола, обсудим самые популярные из них. Электрохимическое окисление фенола на оксидно-рутениево-титановом аноде [12]. Методы AOPs (Advice Oxidative Processes – передовые окислительные процессы) и процессы непрямого окисления, входящие в них, генерирующие in situ экологически чистые окислительные реагенты – активные формы кислорода из воды, пероксида водорода и молекулярного кислорода, как на аноде, так и на катоде или одновременно и на катоде, и на аноде. Активные формы кислорода, генерированные на катоде из углеродного материала или на аноде при окислении воды и H2O2, участвуют в гомогенных реакция с органическим субстратом в растворе. Определяющим фактором здесь является химическая природа материала анода. Материал должен на ряду с достаточно высокой электропроводимостью должен обладать химической устойчивостью при анодной поляризации и каталитической активностью в процессах окисления органических субстратов. Аноды ОРТа (оксидно-рутениево-титанового анода) относятся к комплексным электродом, у которых активные слои состоят из диоксида рутения и диоксида титана. Орта устойчивы в растворах с различным pH. Кроме коррозионной стойкости электрод характеризуется низким перенапряжением выделения хлора и кислорода. Но щелочная среда является более предпочтительной в связи с большей устойчивостью слоев диоксида рутения. Анодные материалы подлежат классификации по способности адсорбировать HO• -радикалы на поверхности электродов. На поверхности анода существуют два вида активных центра: на одних происходит физическая адсорбция HO• -радикалов, а на других – образование высших оксидов за счет внедрения адсорбированных радикалов в кристаллическую решетку оксида. MOx+H2O → MOx(OH•)адс+ H++ e- (1.1) Окисление органического субстрата на центрах, где осуществляется физическая адсорбция, происходит, преимущественно, с минерализацией по уравнению: R + z MOx(OH•) → CO2 + H2O + z MOx +z H++z e- (1.2) Хемосорбированный «активированный кислород» учавствует в образовании частично окисленных продуктов по реакции: R + MOx+1 → RO + MOx (1.3) Использование Ti/SnO2-Sb, Ti/RuO2 и Pt-анодов при оксилении фенола показывает их различие по эффективности и протеканию процесса электрохимической деструкции. Фенол легко деструктурируется на Ti/SnO2-Sb и Pt-анодах. Промежуточные продукты электрохимического превращения фенола, включая бензохинон и органические кислоты, быстро окисляются на Ti/CnO2-Sb-аноде [13]. Появление в электролите H2O2 приводит к дополнительному образованию в растворе высокореакционных радикалов H2O2 → HO2• + H+ + e (1.4) H2O2 + HO2• → OH• + H2O + O2 (1.5) В схеме с барботажем O2 у поверхности графитового катода в состав образующихся АФК могут входить интермедиаты восстановления O2 до пероксида водорода на графите: О2(газ) + 2Н2O + 2е →НО2- + OH-. (1.6) И продукты его взаимодействия с OH•- радикалами, образующимися на аноде: H2O2 + HO• → НО2• + H2O. (1.7) Полное окисление органического субстрата достигается за счет OH•-радикалов. У описанных выше методов есть существенный недостаток – они дороги. Наиболее эффективным их них всех является электрохимическое окисление, так как оно предполагает использование электричество, которое является недорогим ресурсом. Целью данной работы является подбор материала анода, который бы отвечал нескольким критериям. Во-первых, окисление фенола на его поверхности должно проходить максимально полно, во-вторых, его применение должно быть экономически оправданным. В качестве одного из возможных вариантов мы рассматриваем стеклоуглеродные композиты, допированные добавками бензоатов меди, никеля и кобальта. Выбор именно бензоата определялся тем, что сродство структуры этого аниона по отношению к структуре фенолформальдегидной смолы велико. Выбор же катиона обуславливается тем, что Co, Ni, Cu оказывают каталитическое действие при процессах, связанных с отчисткой воды от фенолов [14]. 1.3 Общая информация о бензоатах кобальта, никеля и меди Бензоат меди представляет собой неорганическое соединение, которое получают из соли меди и бензойной кислоты. Cu(C6H5COO)2∙nH2O – молекулярная формула соединения, где n – чисто молекул воды. Бензоат меди слабо растворим в воде и этаноле, а также склонен к образованию кристаллогидратов. Бензоат никеля так же представляет собой неорганическое соединение, которое получают из соли никеля и бензойной кислоты. Ni(C6H5COO)2∙nH2O – молекулярная формула соединения, где n – чисто молекул воды. Бензоат никеля применяется в качестве катализатора для реакции получения ацетофенона при окислении этилбензола в жидкой фазе. Бензоат кобальта – это неорганическое соединение, которое получают из соли кобальта и бензойной кислоты. Соединение обладает молекулярной формулой Co(C6H5COO)2∙nH2O, где n – число молекул воды. 1.4 Методы исследования: рентгенофазовый анализ, сканирующая электронная микроскопия, термолиз Для выполнения поставленных задач необходимо прибегнуть к определенным методом анализа. Для установления элементного состава полученных продуктов – сканирующая электронная микроскопия. СЭМ или сканирующая электронная микроскопия – метод, который мы применяем. Сканирующий электронный микроскоп использует отраженные и вторичные электронные лучи и позволяет добиться разрешающей способности около двух нм. В качестве носителя в СЭМ используется сплошная шайба из проводящего материала, на которую прикрепляются образцы. Для закрепления образцов используется скотч, в котором кроме углеводородов, из которых скотч и состоит отсутствуют другие примеси [15]. После того, как образцы, закрепленные на шайбе, помещаются в специальное отделение, на образец падает электронный луч. На пути его движения стоят специальные управляющие электроды, которые обеспечивают фокусировку и перемещение луча по образцу [16]. Если рассмотреть строение самого комплекса, то можно сказать, что электронная пушка располагается вверху колоны, а образец и детектор снизу [17]. Принцип этого метода рентгенофазового анализа заключается в том, что луч попадает на детектор, который определяет его интенсивность. И излучатель, и детектор размещены на гониометре, который позволяет точно определить угол [18]. Каждый пик на дифрактограмме – это расстояние между кристаллическими гранями или атомами. Необходимо понимать, что РФА – не позволяет определить структуру. Дифрактограмма позволяет кристаллическое вещество идентифицировать и определить фазу [19]. Для того, чтобы снять дифрактограмму, необходимо было провести определенные манипуляции. Первая – подготовка образца. Соединение помещалось в ступку из яшмы и перетиралось до состояния – тонко измельченного порошка. Материал ступки – совершенно инертен, что позволяет избегать взаимодействия с ним образца и, как следствие, определенных продуктов. После перетирания вещество помещалось в специальную кювету. Вещество должно быть хорошо выравнено в кювете, иначе могут появиться посторонние шумы на дифрактограмме. Последний необходимой манипуляцией является протирание кюветы и помещение ее в дифрактометр [20]. Для изучения процессов, протекающих в образце при нагревании – термогравиметрия. Под термическими методам понимается группа методов физико-химического анализа, в которых какой-либо физический параметр системы зависит от температуры. Калориметрия и термогравиметрия относятся к термическим методам анализа. В термогравометрии изменяется масса вещества, а в калориметрии – теплота [20]. Применяется термический анализ для изучения свойств вещества и процессов, протекающих в нем при нагревании или охлаждении по заданной программе. Проводится он с помощью специальной аппаратуры, результатом работы которой являются термограммы. Термограммы, главным образом, зависят от химического состава и структуры исследуемого объекта [21]. Самым распространенным и основным методом термического анализа является дифференциально-термический анализ (ДТА), который позволяет выявить и исследовать фазовые превращение и химические реакции, протекающие с веществом при изменении температуры по термическим эффектам, которые сопровождают изменения. На ряду с ДТА, широко применяется метод исследования вещества и процессов, протекающих в веществе при нагревании с изменением массы, который называется термогравиметрический анализ. Всего выделяют три вида термогравиметрии: Изотермическую – измерение массы образца, в течении определенного времени, при заданной температуре. Квазистатическую – измерение образца при каждой из ряда возрастающих температур до достижения постоянного значения массы [22]. Динамическую – изменение температуры среды, окружающей образце, по заранее заданному закону. Наиболее распространенной является динамическая термографиметрия. В основе термогравиметрии (ТГ) находится принцип, по которому при нагревании учитываются изменения, приводящие к уменьшению или увеличению массы изучаемого вещества [23]. Уменьшение массы вещества возможно при протекании следующих процессов. Возгонка: I2(тв.) → I2(газ). Испарение. Дегидратация: CaSO4·2 H2O → CaSO4·0,5 H2O + 1,5 H2O (при Т=120°С). Десорбция. Увеличиваться масса вещества может, например, при абсорбции газов или окислении и карбонизации исследуемых веществ. Для получения термогравиметрических кривых определяется потеря в массе вещества в процессе нагревания до высоких температур. Кривая зависимости потери массы от температуры находится в координатах абсцисса – температура, ордината – потеря массы в граммах или процентах. Такая кривая показывает всю потерю массы от начала и до конца процесса (рисунок 1.1). При расшифровке простой кривой потери массы возникают проблемы, так как не удается разделять стадии, которые следуют друг за другом. Решение этой проблемы лежит в дифференциальной кривой потери массы (рисунок 1.2), записанной в таких же координатах. Построение такой кривой может производиться путем графического дифференцирования на основании данных, полученных в результате предварительной записи простой кривой потери массы изучаемого вещества. Для записи такой кривой применяются специальные термовесы. 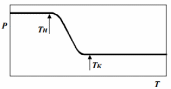 Рисунок 1.1 – Пример кривой ТГ для одностадийного процесса Так же, возможно снятие кривой дифференциальной сканирующей калориметрии [24], которая показывает разницу температур образца и эталона в течении времени или температур, когда они подвергались одинаковой температурной программе.  Рисунок 1.2 – Пример дифференциальной кривой ТГ Суть метода заключается в том, что параллельно регистрируются температуры инертного образца и исследуемого вещества при их нагревании или охлаждении. Когда происходит изменение температуры, в образце могут протекать различные процессы с изменение энтальпии, например, перестройка кристаллической структуры, испарение, дегидратация, плавление, разложение, окисление или восстановление. Эти процессы происходят с поглощение или выделением тепла, поэтому и появляется разница в температурах образца и эталона. Благодаря конструкции прибора, а именно тому, что регистрирующие термопары от образца и эталона соединены навстречу друг другу, удается зафиксировать даже малые изменение температуры образца. Вследствие повышенной чувствительности дифференциального метода исследоваться могут даже образцы малого веса (до нескольких мг). Экспериментальный сигнал от двух ячеек A и B (рисунок 1.3.) измеряется одновременно. Поскольку ячейки сконструированы симметрично все процессы, кроме относящихся к образцу, действуют на них одинаково и могут быть исключены из рассмотрения путем вычитания сигнала вычитанием от ячейки сравнения из сигнала от ячейки с образцом. 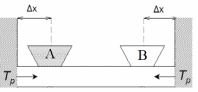 Рисунок 1.3 – Схема измерительной ячейки дифференциального термического анализа, где Тр – температура нагревателя Площадь пика кривой ДТА пропорциональная изменению энтальпии при различных процессах в образце и его массе. У такой двойной конструкции существует ряд недостатков, которые не позволяют полностью исключать тепловые потери: невозможно сконструировать полностью симметричную измерительную ячейку; невозможно подобрать инертный образец сравнения, по физическим свойствам полностью идентичный образцу. Эти недостатки приводя к тому, что температура измерительных ячеек немного различается, а значит, различается и количество теплоты, которые переносится между ячейками и оболочкой, в том числе и путем теплового излучения и конвекции. Следует рассмотреть факторы, которые влияют на характер кривых. Факторы, связанные с прибором: – атмосфера печи; – размер и форма печи; – материал держателя образца; – размещение термопары относительно образца. Характеристики образца: – размер частиц образца; – масса образца; – теплопроводность; – теплоемкость; – плотность упаковки частиц образца; – усадка образца; – степень кристалличности. Наличие «тепловых утечек» не только вносит погрешность, но и приводит к необходимости многократной калибровки прибора. Многие карбоксилаты Co, Ni, Cu, например, NiC2O4, CoC2O4 и Co(CH3COO)2 разлагаются на воздухе без образования карбонатов или оксокарбонатов как промежуточных продуктов, в отличие от ацетата кальция [25]. Вместе с тем для относительно крупных катионов, способных образовывать устойчивые до высоких температур карбонаты, образование последних как промежуточных продуктов термолиза нельзя исключать. Появление оксокарбонатов, например, La2O2CO3 и Nd2O2CO3 отмечается на термограммах карбоксилатов редкоземельных элементов: La(CH3COO)3 и Nd(CH3COO)3. Оксокарбонаты La2O2CO3 и Nd2O2CO3 разлагаются до оксидов лишь выше 700–800 °С. При разложении La(CH3COO)3 и Nd(CH3COO)3 можно также выделить ступень, соответствующую образованию LaO(CH3COO) и NdO(CH3COO), разлагающихся около 400–500 °С. Образование подобных соединений Co, Ni, Cu маловероятно, но полностью исключать нельзя. Рассмотрение кривых термолиза карбонатов кобальта, никеля и меди позволяет заключить, что при медленном нагреве они в диапазоне соответственно 200–300 °С для кобальта и 300–400 °С для никеля и меди превращаются в оксиды Co3O4, NiO и CuO [25]. Это дает право предполагать, что и при термолизе карбоксилатов данных металлов не могут существовать карбонаты или оксокарбонаты этих металлов выше указанных температур: 300 °С для кобальта и 400 °С для никеля и меди. Для всех трех металлов также известны термограммы 8-гидроксихинолинатов на воздухе, которые показали, что около 400 °С все они разлагаются до тех же оксидов. Вместе с тем, термограммы 8-гидроксихинолинатов, взятых в большом количестве (около 1 грамма) и нагреваемых сравнительно быстро (10 °С/мин), имеют протяженный участок вплоть до 600 °С, сопровождаемый потерей массы и выделением тепла, что можно интерпретировать как окисление (горение) углеродистого остатка (кокса), образовавшегося в смеси с оксидами металлов из органических осколков анионов. Образование углеродистого остатка при нагревании салицилатов кобальта, никеля и меди также весьма вероятно, поскольку при термолизе в продуктах разложения будет высоким отношение углерода к водороду и кислороду, что препятствует образованию летучих соединений углерода, таких как метан или углекислый газ. 1.5 Стеклоуглерод, как перспективный материал, для получения электродов Современная промышленность испытывает потребность в новых конструкционных материалах, которые способны выдерживать высокие температуры и воздействие агрессивных сред. Наиболее необходимы материалы непроницаемые для газов и жидкостей, обладающие также высокой прочностью. Подходящими являются пирографит и стеклоуглерод, но пирографиту присуща анизотропия тепловых, механических и электрических свойств. А стеклоуглерод подобной анизотропией не обладает [25]. Стеклоуглерод и изделия из него могут быть получены при термическом разложении некоторых полимеров, которые при пиролизе превращаются в карбонизованные продукты. Сырьевым материалом могут служить синтетические смолы, например, фенолформальдегидная смола, полимерные смолы, на основе фурфурола [26]. В основе наиболее широко используемой технологии получения стуклоуглерода лежит процесс пиролиза фенолформальдегидной смолы. При нагревании выше 300 °С меж- и внутри молекулярная дегидратация за счёт финолных OH – групп приводит к развитию полимеров. Выше 500 °С начинается интенсивная ароматизация фенольной смолы. Карбонизация и ароматизация продукта пиролиза фенолформальдегидной смолы происходят в результате дегидрирования ароматических ядер и частично метиленовых мостиков. При дальнейшем нагревании происходит окончательная карбонизация продукта. Углеродные атомы образуют искаженные двумерные графитоподобные слои, которые соединены в трехмерную полимерную структуру атомами углерода с тетраэдрической связью. Это придает структуре стеклоуглерода большую плотность. Свойства зависят от режима термообработки, то есть, даже при использовании одинакового сырья возможно получения материалов с различными физико-механическими свойствами [27]. До температуры 4000 К стеклоуглерод остается твердым, не изменяя своих свойств. Плотность стеклоуглерода около 1,5 г/см3, что значительно прочнее обычных промышленных маркировок графита. Стеклоуглерод хорошо проводит электрический ток, однако удельное сопротивление выше по сравнению с обычными марками графита и приближается по значению к электросопротивлению сажевых сортов искусственного графита. Стеклоуглерод – важный материал, сочетающий свойства графита и стекла, а также, химически инертный. В связи с высокой твердостью изделия из стеклоуглерода с трудом поддаются механической обработке. Благодаря особым свойствам из стеклоуглерода может изготавливаться химическая посуда, тигли. В связи с высокой электропроводностью стеклоуглерод может быть использован в качестве электродов. 1 2 |
