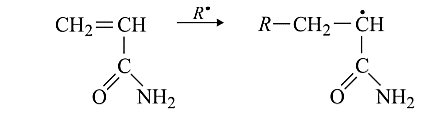М. В. Ковалев 2020 получение карбоксилсодержащего полиакриламида методом щелочного гидролиза полиакриламида отчет о лабораторной работе по дисциплине Полимеры в биологически активных системах сгту 18. 03. 01 002 лр
 Скачать 391.67 Kb. Скачать 391.67 Kb.
|
|
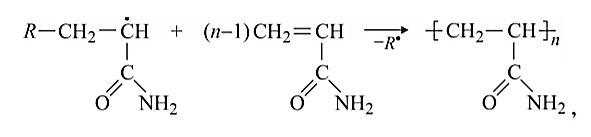
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Самарский государственный технический университет» Кафедра «Химическая технология биологически активных веществ и полимерных композитов» Отчет защищен с оценкой __________ Преподаватель к.х.н., доцент _______ М.В. Ковалев «___» __________ 2020 ПОЛУЧЕНИЕ КАРБОКСИЛСОДЕРЖАЩЕГО ПОЛИАКРИЛАМИДА МЕТОДОМ ЩЕЛОЧНОГО ГИДРОЛИЗА ПОЛИАКРИЛАМИДА Отчет о лабораторной работе по дисциплине «Полимеры в биологически активных системах» СГТУ 18.03.01 – 002 ЛР Отчет выполнила студентка гр. ХТБ-43 ______ Н.Л. Самохина «___» __________ 2020 2020 Цели работы: Получить карбоксилсодержащий полиакриламид; Изучить кинетические закономерности щелочного гидролиза полиакриламида при заданных условиях. Теоретическая часть В настоящее время широко применяются водорастворимые полимеры на основе акриламида (АА; рисунок 1 а), которые объединены общим названием «полиакриламиды». Полиакриламиды (ПАА; рисунок 1 б) – общее название группы карбоцепных полимеров и сополимеров на основе акриламида и других ненасыщенных амидов. По правилам ИЮПАК основное название полиамидакрила – поли(2-пропенамид) или поли(1-карбамоилэтилен). 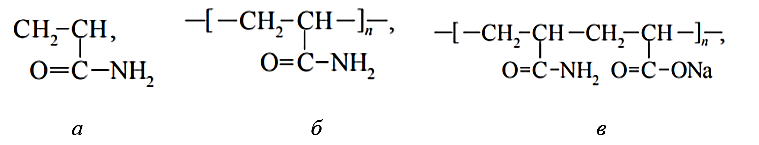 Рисунок 1 – Структурные формулы: а – акриламида, б - полиакриламида. Получение полиакриламида Акриламид легко полимеризуется с образованием линейного высокомолекулярного полимера под действием радикальных и ионных инициаторов, ультрафиолетового и радиационного излучения, ультразвука и электрического тока. Упрощенно радикальная полимеризация может быть представлена следующей схемой (рисунок 2) [1].
Радикальная полимеризация – основной промышленный метод получения водорастворимого ПАА. На полимеризацию АА существенно влияет pH реакционной среды. При низких рН и высоких температурах возможно образование нерастворимых в воде сшитых полимеров вследствие создания между макромолекулами имидных мостиков (–CO–NH–CO–), а при высоких рН протекает гидролиз амидных групп. Последнюю реакцию можно использовать для получения на стадии полимеризации частично гидролизованного ПАА (до 30 %). Полимеризацию проводят в водных растворах, в водно-органических растворителях и дисперсиях (в каплях водного раствора мономеров, диспергированных при механическом перемешивании в органических жидкостях в присутствии стабилизатора исходной дисперсии и образующегося полимера). В зависимости от способа полимеризации полимеры получают в виде растворов, гранул, порошка и дисперсий полимеров в органических жидкостях. Распространенным промышленным способом является полимеризация АА в водных растворах, что обусловлено получением полимеров со скоростью и ММ, недостижимыми при полимеризации в органических растворителях. Полимеры АА обладают уникальным комплексом полезных свойств и широко используются в различных областях техники и технологии. Различные области применения и назначение полимеров показаны в таблице 1. Таблица 1 – Применение полимеров акриламида
Потенциометрическое титрование Основано на регистрации изменения потенциала индикаторного электрода в процессе титрования в соответствии с изменением концентрации титруемого вещества в процессе прибавления титранта. В ходе потенциометрического титрования протекают две реакции: основная химическая реакция титрования и электрохимическая реакция на индикаторном электроде. Выбор индикаторного электрода определяется типом протекающей реакции, природой определяемых ионов или ионов титранта, а также удобством работы с электродом. Потенциал индикаторного электрода должен устанавливаться быстро, и также быстро реагировать на изменение концентрации титруемых ионов, достаточно резко изменять свою величину (скачок титрования) вблизи точки эквивалентности (ТЭ) при незначительном изменении концентрации потенциалопределяющих ионов. Это резкое изменение потенциала индикаторного электрода связано с заменой одной индикаторной реакции (до ТЭ) на другую (после ТЭ) и является признаком конца титрования. Величина скачка титрования связана с константой соответствующего химического равновесия, с условиями определения (концентрацией титруемого раствора и титранта, температурой, присутствием посторонних веществ и т.д.). Электрод сравнения (стандартный электрод) не должен изменять свой потенциал при прохождении тока, т.е. этот электрод не должен поляризоваться. Для проведения потенциометрического титрования создают полную электрохимическую цепь, состоящую из индикаторного электрода, помещенного в анализируемый раствор, который соединен с электродом сравнения при помощи солевого мостика. Электроды индикаторный и сравнения могут быть помещены в один анализируемый раствор (анализируемую среду). Полученный гальванический элемент подключают к потенциометру. В потенциометрическом титровании используют следующие химические реакции: 1) кислотно-основные; 2) осаждения; 3) комплексообразования; 4) окисления-восстановления. Во всех случаях реакция между определяемым ионом и реагентом должна идти с большой скоростью и до конца, быть стехиометрической. Должны отсутствовать также посторонние ионы, которые могут взаимодействовать с данным реагентом, т.е. отсутствовать побочные химические реакции титранта с посторонними ионами. Титрование смеси сильного и слабого оснований. При титровании смеси сильного и слабого основания сильной кислотой на кривой титрования наблюдаются два скачка потенциала. Сильное основание полностью подавляет диссоциацию слабого основания, поэтому начальный участок кривой не отличается от кривой титрования сильного основания. После полной нейтрализации сильного основания титруется слабое основание, поэтому последующий участок кривой практически не отличается от кривой титрования слабого основания. Форма кривой титрования смеси основания зависит от силы слабого основания. Если константа диссоциации слабого основания относительно велика, то дифференцированное титрование с двумя скачками потенциала невозможно (если константы диссоциации кислот отличаются по силе в 10 000 раз). Исходя из констант диссоциации (Кд(КОН) = 2,9; Кд(NH4OH) = 1,8·10-5; Кд(сополимера ПАА с акриловой кислотой) ≈ 5,6·10-13) первым титруется раствор гидроксида калия, вторым раствор аммиака и третьим сополимер ПАА с акриловой кислотой (очень слабое основание). Методическая часть Реактивы и оборудование: Водный раствор полиакриламида (1 %) Водный раствор гидроксида калия (0,5 N) Раствор соляной кислоты (0,1 N) Дистиллированная вода Трёхгорлая колба 100 см3 Обратный холодильник Термометр Электромеханическая и электромагнитные мешалки Водяная баня Пипетка 10 см3 Ионометр со стеклянным и хлорсеребряным электродами Стеклянные бюксы 40 см3 Мерные колбы 100 см3 Бюретка для титрования В мерных колбах готовят раствор полиакриламида (ПАА) с заданной концентрацией. Объем исходного раствора ПАА, который необходимо взять для приготовления требуемого количества раствора ПАА с заданной концентрацией рассчитывается по формуле: 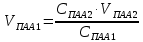 где 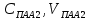 – концентрация и объем заданного раствора ПАА; – концентрация и объем заданного раствора ПАА;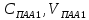 – концентрация и объем исходного раствора ПАА, который необходимо взять для приготовления требуемого количества раствора ПАА с заданной концентрацией. – концентрация и объем исходного раствора ПАА, который необходимо взять для приготовления требуемого количества раствора ПАА с заданной концентрацией.Полученные 50 мл раствора ПАА переносят в четырёхгорлую колбу и нагревают до температуры 70 °С. По достижению раствором этой температуры к нему при постоянном перемешивании приливают 25 см³ 0,5 N раствора гидроксида калия. Для получения 0,5 N раствора гидроксида калия рассчитывают его массу: mKOH = СKOH ∙VKOH ∙ MKOH / 1000 = 0,5∙25∙56/1000 = 0,7 г 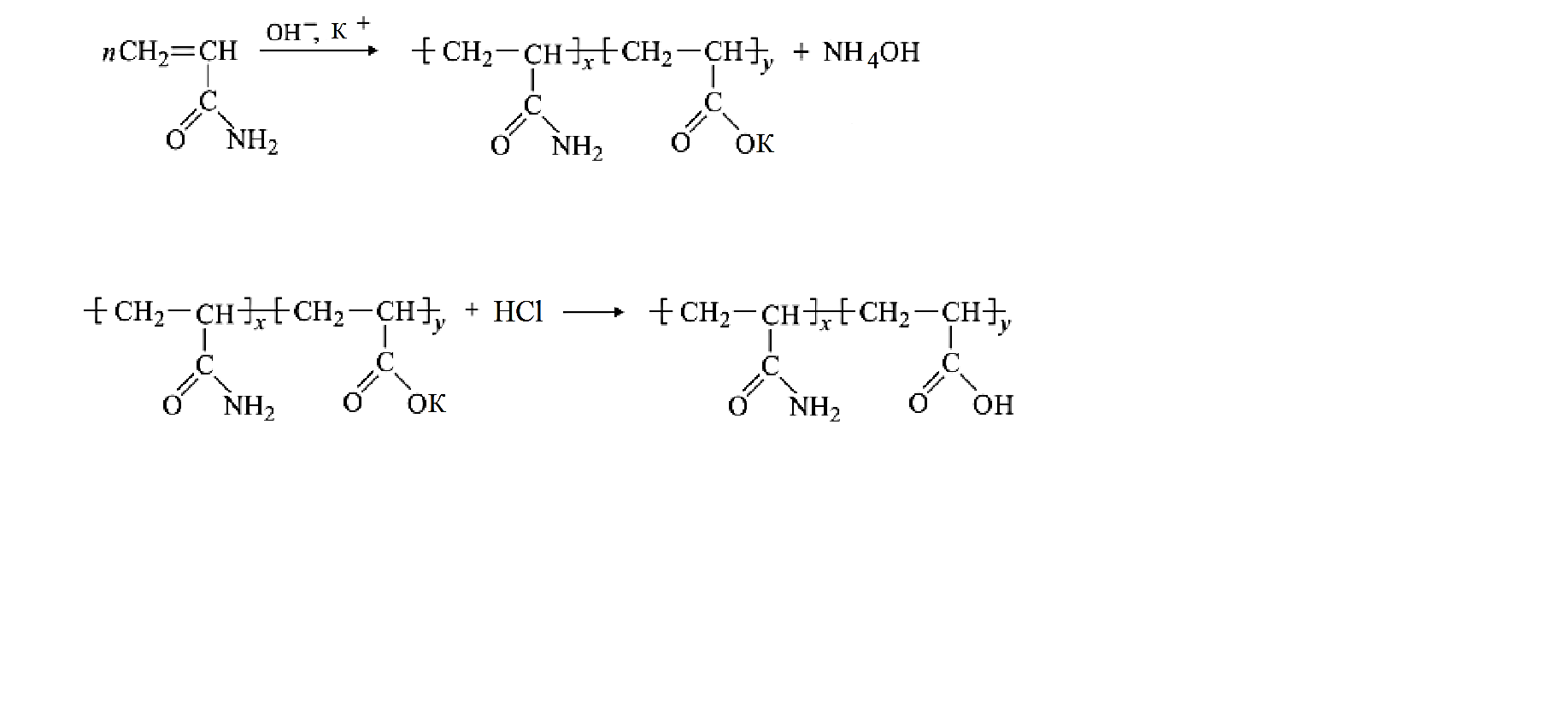 Рисунок 3 – Щелочной гидролиз ПАА с гидроксидом калия При титровании реакционной смеси происходят следующие реакции, схемы которых представлены ниже: 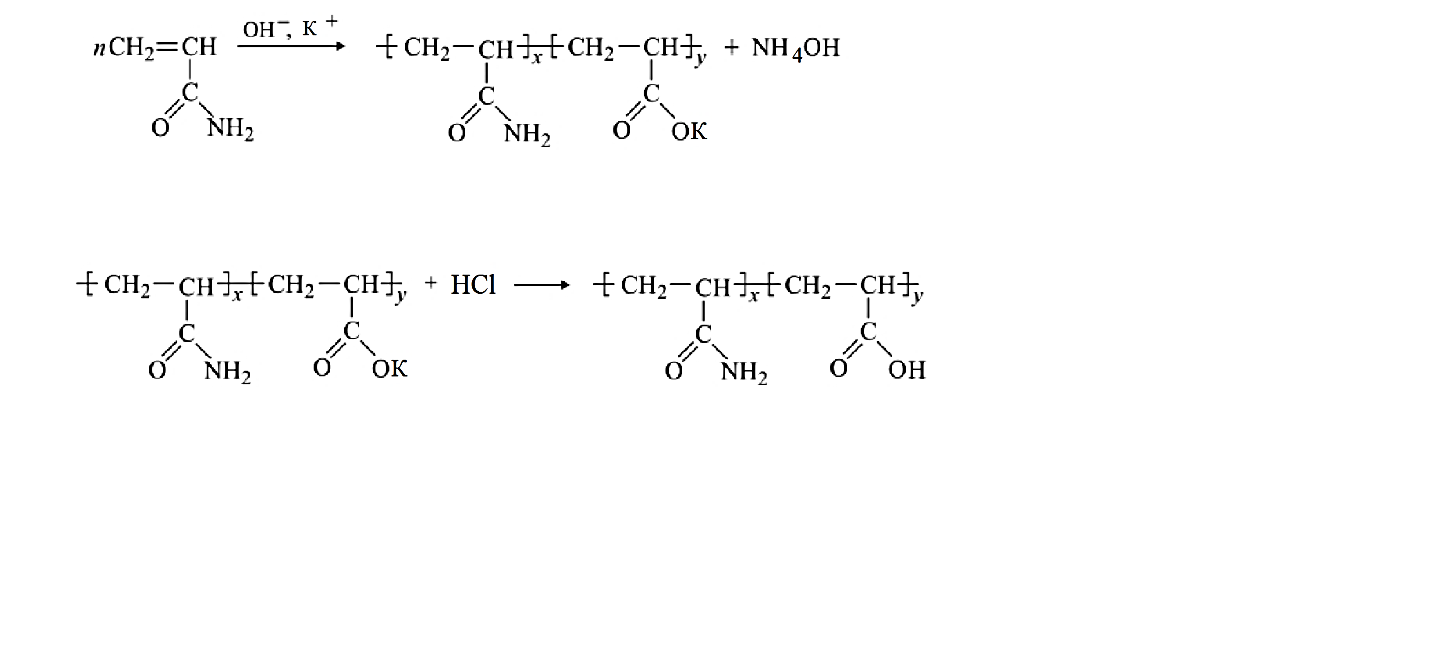 HCl + KOH → KCl +H2O NH4OH + HCl → NH4Cl + H2O На протяжении реакции берутся пробы раствора через 30, 60, 90, 120 минут после начала реакции. Изучение кинетических закономерностей щелочного гидролиза ПАА сводится к определению степени гидролиза ПАА в процентах. Поскольку ПАА является высокомолекулярным соединением, макромолекулы которого характеризуются различной степенью полимеризации, степень гидролиза ПАА определяется как отношение суммарного количества моль гидролизованных звеньев акриламида в составе ПАА к общему их количеству, умноженное на 100 %. Определение количества моль гидролизованных звеньев акриламида в составе ПАА определяют методом потенциометрического титрования аликвотной части реакционной смеси 0,1 N соляной кислотой. Потенциометрическое титрование реакционной смеси соляной кислотой Прежде чем приступить к титрованию, необходимо провести проверку прибора (иономера), а в случае необходимости – его калибровку. Проверка иономера заключается в сравнении показаний прибора при измерении характеристик (pH) стандартных кислых и щелочных буферных растворов. Если показания прибора при измерении pH буферных растворов не совпадают с их стандартными характеристиками (pH) производят настройку (калибровку) прибора, согласно прилагаемой к нему инструкции. Для приготовления берут шприцем или пипеткой 10 см3 реакционной смеси и количественно переносят в колбу для титрования. Для количественного переноса реакционной смеси в колбу необходимо пипетку или шприц дважды промыть дистиллированной водой. Это позволяет перенести в колбу для титрования остатки реакционной массы с краев пипетки или шприца и, тем самым, добиться необходимой точности анализа. Проводят измерение pH реакционной массы с помощью иономера. Титрование проводят 0,1 N соляной кислотой. В процессе титрования фиксируют объём титранта (соляной кислоты) при изменении pH титруемой смеси на каждые 0,2 единицы pH. Титрование считают законченным при достижении значения pH титруемой смеси равного 1. В процессе титрования гидролизованного ПАА происходят конформационные изменения его макромолекул. Равновесные конформации макромолекул гидролизованного ПАА и равновесные значения pH при титровании устанавливаются не мгновенно, а в определённом временном интервале, который зависит от многих факторов (степени гидролиза, температуры, концентрации титруемой смеси и титранта и т.д.). При титровании необходимо фиксировать только равновесные значения pH титруемой смеси, в противном случае результаты титрования будут недостоверными. Поэтому необходимо выбирать определённую интенсивность титрования, позволяющую фиксировать равновесные значения pH [3]. Расчётная часть Результаты титрования для четырех проб заносим в таблицу 1. По данным, приведённым в таблице, строим графики зависимости рН реакционной массы от объёма титранта. Таблица 2 – Значения pH и соответствующие объёмы соляной кислоты при титровании реакционной смеси через 30 минут
Таблица 3 – Значения pH и соответствующие объёмы соляной кислоты при титровании реакционной смеси через 60 минут
Таблица 4 – Значения pH и соответствующие объёмы соляной кислоты при титровании реакционной смеси через 90 минут
Таблица 5 – Значения pH и соответствующие объёмы соляной кислоты при титровании реакционной смеси через 120 минут
По данным, приведённым в таблицах, строим графики зависимостей pH реакционной массы от объёма титранта. По графику находим объём соляной кислоты, пошедший на титрование гидролизованных звеньев ПАА (звеньев акрилата калия). 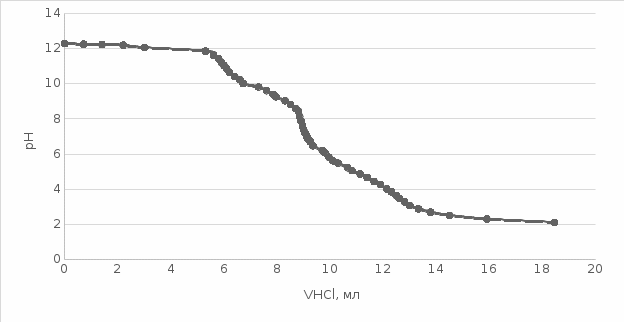 Рисунок 4 – Графическая зависимость рН пробы через 30 минут ПАА от объёма соляной кислоты 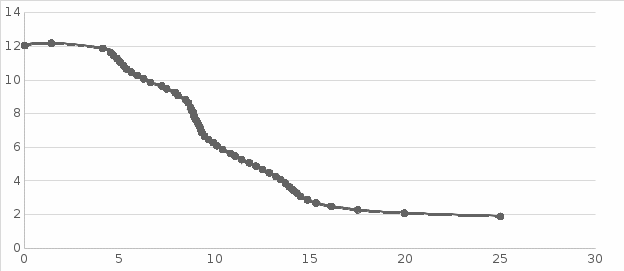 Рисунок 5 – Графическая зависимость рН пробы через 60 минут ПАА от объёма соляной кислоты 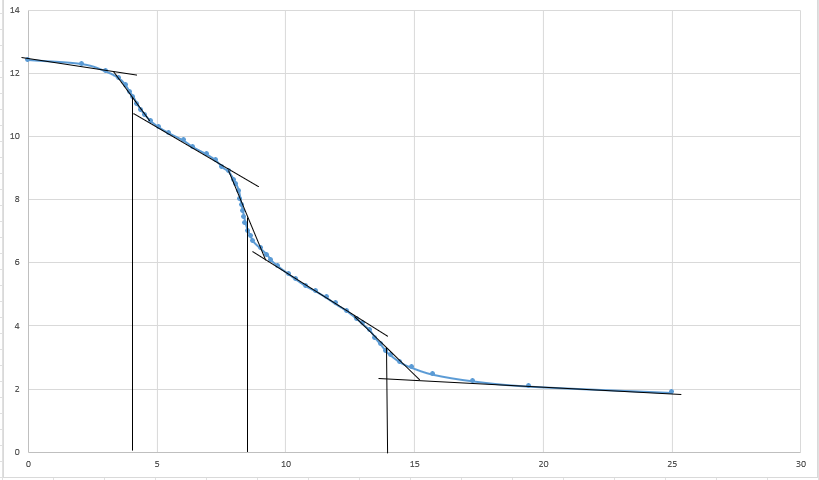 Рисунок 6 – Графическая зависимость рН пробы через 90 минут ПАА от объёма соляной кислоты 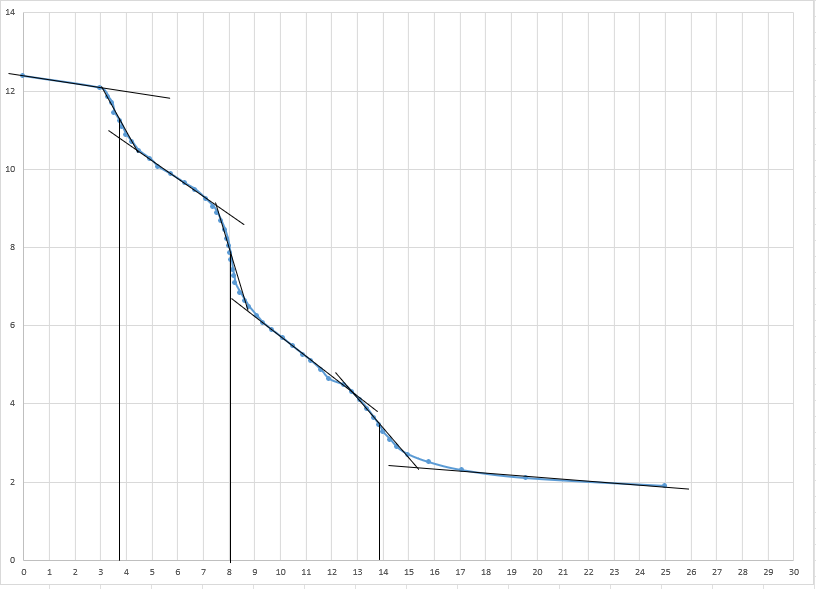 Рисунок 7 – Графическая зависимость рН пробы через 120 минут ПАА от объёма соляной кислоты Степень гидролиза ПАА рассчитываем по формуле: 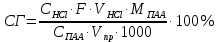 где СHCl – нормальность соляной кислоты; F – фактор соляной кислоты; VHCl – объём соляной кислоты, пошедший на титрование; MПАА – молекулярная масса мономерного звена ПАА, CПАА – молярная концентрация ПАА в реакционной смеси; Vпр – объём пробы, взятой для титрования (см3). 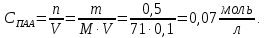 Объем соляной кислоты, пошедшей на титрование гидролизованных звеньев ПАА составил: V(HCl)30 = 3,55 мл V(HCl)60 = 5,30 мл V(HCl)90 = 5,45 мл V(HCl)120 = 5,85 мл Таблица 6 – Значения объемов соляной кислоты, пошедшей на титрование гидролизованных звеньев ПАА и степени гидролиза в различные промежутки времени
Для 30 минут В 75 мл – 0,5 г 10 мл – х 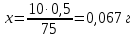 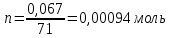 Моль HCl 0,1 – 1000 мл х – 3,55 мл 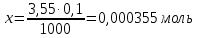 0,00094 – 100 % 0,000355 – х 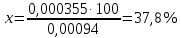 . .Для 60 минут 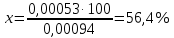 . .Для 90 минут 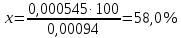 . .Для 120 минут 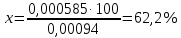 . .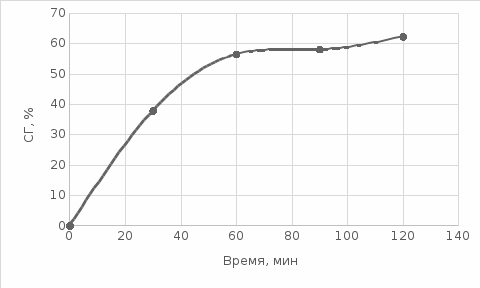 Рисунок 8 – График зависимости степени гидролиза от времени Экспериментальные данные показывают, что степень гидролиза на протяжении всей реакции меняется каскадно. Возрастание степени гидролиза происходит за счет увеличения степени превращения ПАА. Со временем концентрация KOH, NH4OH уменьшается. Степень гидролиза не достигает 100 % из-за: 1) действия «эффекта соседа»; 2) недостаточного времени реакции; 3) электростатического эффекта. Вывод: получили карбоксилсодержащий полиакриламид и изучили кинетические закономерности щелочного гидролиза полиакриламида при заданных условиях: с течением времени степень гидролиза возрастает. |