NAD(P)H:FMN-оксидоредуктаза Vibrio harveyi. Малышева_1.2. Малышева В. В. Бб1901Б. Задание Эссе nad(P)H fmnоксидоредуктаза Vibrio harveyi Почему я выбрала эту белковую молекулу nad(P)H fmnоксидоредуктаза
 Скачать 326.59 Kb. Скачать 326.59 Kb.
|
|
Малышева В.В. ББ19-01Б. Задание 1.2. Эссе « NAD(P)H:FMN-оксидоредуктаза Vibrio harveyi » Почему я выбрала эту белковую молекулу – «NAD(P)H: FMN-оксидоредуктаза»? Наверно, потому что в своем дипломном исследовании для экспериментов я использую непосредственно ее ( А еще уже прошло больше года, как я вижу название этой белковой молекулы, например, в своей курсовой, различных научных статьях, в литературном обзоре своего диплома! И до сих пор я не знаю ее функций и, тем более, в глаза не видела ее молекулярную модель! Это ужасно и стыдно. А вдруг у меня об этом на защите спросят! Обещаю исправить данное положение и заполнить пробел в моих знаниях). А почему именно NAD(P)H:FMN-оксидоредуктаза Vibrio harveyi ? Так сложились обстоятельства, кто – то уже пишет подобное эссе по NAD(P)H: FMN-оксидоредуктазе Vibrio fischeri, а я просто не хотела повторяться! ( Надеюсь, что этот человек после выполнения задания даст почитать мне свое эссе).  Рис.1. Главное правило – не пиши того, чего не знаешь (А я напишу!), Или доказательства того, что я действительно использую и упоминаю о NAD(P)H: FMN-оксидоредуктазе в своем исследовании. Пришло время проверить, что же я узнала о NAD(P)H: FMN-оксидоредуктаза Vibrio harveyi? Оказывается, что в реакции NAD(P)H: FMN-оксидоредуктаза с бактериальной люцефиразой происходит образование комплекса между этими белковыми молекулами с окислением восстановленного флавинмононуклеотида (FMNH2) с образование биолюминесценции и воды. А от стабильности белок белкового взаимодействия между NAD(P)H: FMN-оксидоредуктазой и бактериальной люциферазой зависит стабильность свечения ( а вот стабильное свечение нам нужно для проведения экспериментов) [1]. А выявить стабильность белок белкового взаимодействия между NAD(P)H: FMN-оксидоредуктазой и бактериальной люциферазой можно с помощью молекулярного моделирования ! (Кстати, Vibrio harveyi получается не очень стабильный комплекс между NAD(P)H: FMN-оксидоредуктазой и бактериальной) [2]. 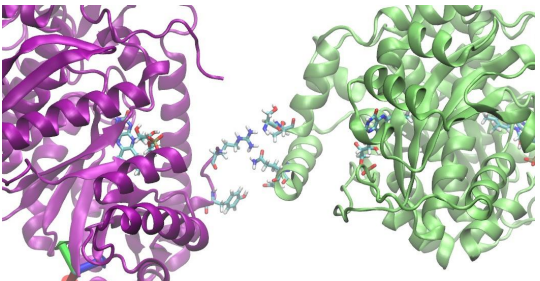 Рис. 2. Фрагмент комплекса бактериальной люциферазы (слева) и NADPH:FMN-оксидоредуктазы (справа), в котором возможен прямой перенос FMNH2. Теперь я знаю функцию NADPH:FMN-оксидоредуктазы и бактериальной люциферазы. Теперь мне не стыдно, что я не знаю того, что должна была знать очень давно. Было полезно узнать, что с помощью молекулярного моделирования я могу узнать стабильность белок белкового комплекса и, следовательно стабильность свечения благодаря этому комплексу! Список литературы Campbell, Z.T. Fre is the major flavinreductase supporting bioluminescence from Vibrio harveyi luciferase in Escherichia coli/ Z.T. Campbell, T.O. Baldwin// The Journal of Biological Chemistry. – 2009. – Vol. 284 - № 13 –pp. 8322-8328. Structural Studies on Flavin Reductase PheA2 Reveal Binding ofNAD in an Unusual Folded Conformation and Support Novel Mechanism of Action/ Robert H. H. van den Heuvel, Adrie H. Westphal, Albert J. R. Heck, Martin A. Walsh, Stefano Rovida, Willem J. H. van Berkel, and Andrea Mattevi // Journal of Biological Chemistry. – 2004. –Vol. 279, № 13- pp. 12860–12867. |
