Лабораторное занятие 15-1642031048620. Марганец и его соединения
 Скачать 47.25 Kb. Скачать 47.25 Kb.
|
|
Лабораторная работа № 8 Тема: Марганец и его соединения. Цель работы: Получение манганата калия и изучение свойств марганца и его соединений. Приборы и посуда. 1) Штатив с лапкой. 2) Горелка. 3) Штатив с пробирками. Реактивы и материалы. 1) Оксид свинца (IV) 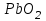 (или сурик (или сурик 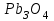 ). 2) Оксид марганца (IV) ). 2) Оксид марганца (IV) 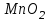 (зерненый). 3) Гидроксид калия (зерненый). 3) Гидроксид калия 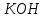 4) Перманганат калия 4) Перманганат калия 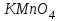 . 5) Хлорат калия . 5) Хлорат калия 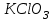 . 6) Сульфат марганца . 6) Сульфат марганца 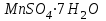 . 7) Лакмусовая бумага. 8) Лучинка. . 7) Лакмусовая бумага. 8) Лучинка.Растворы. 1) Азотная кислота 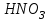 (пл. 1,4). 2) Серная кислота (пл. 1,4). 2) Серная кислота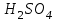 (пл. 1,84 и 2 н.). 3) Сернистая кислота (пл. 1,84 и 2 н.). 3) Сернистая кислота 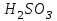 . 4) Уксусная кислота . 4) Уксусная кислота 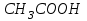 (2 н.). 5) Щавелевая кислота (2 н.). 5) Щавелевая кислота 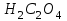 (1 н.). 6) Гидроксид натрия (1 н.). 6) Гидроксид натрия 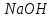 (40%-ный и 2 н.). 7) Сульфид аммония (40%-ный и 2 н.). 7) Сульфид аммония 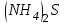 . 8) Сульфат железа (II) . 8) Сульфат железа (II) 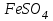 (0,5 н.). 9) Бромид калия (0,5 н.). 9) Бромид калия 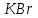 (0,5 н.). 10) Перманганат калия (0,5 н.). 10) Перманганат калия 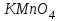 (0,1 н.). 11) Сульфат марганца (II) (0,1 н.). 11) Сульфат марганца (II) 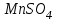 (0,5 н.). 12) Сульфит натрия (0,5 н.). 12) Сульфит натрия 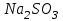 (1 н.). 13) Хлорная вода. 14) Бромная вода. (1 н.). 13) Хлорная вода. 14) Бромная вода.Опыт № 1. Получение гидроксида марганца (ii) и его свойства а) Получить гидроксид марганца (II) из соли 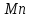 (II). Отметить его цвет. Написать уравнение реакции. (II). Отметить его цвет. Написать уравнение реакции.б) Часть жидкости с осадком отлить в другую пробирку и оставить стоять на воздухе. Объяснить изменение цвета осадка. Написать уравнение реакции. в) Испытать отношение полученного в начале опыта осадка к разбавленной кислоте и избытку раствора щелочи. Что происходит? Какой вывод можно сделать о свойствах гидроксида марганца (II)? Написать уравнение реакции. г) К небольшому количеству осадка гидроксида 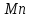 (II) прилить бромной воды. Что образуется? Какие свойства проявляет гидроксид (II) прилить бромной воды. Что образуется? Какие свойства проявляет гидроксид 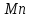 (II) в этой реакции? Написать уравнение реакции. (II) в этой реакции? Написать уравнение реакции.Опыт № 2. Свойства солей марганца (II) а) К раствору соли 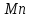 (II) прибавить раствор сульфида аммония. Что выпадает в осадок? Каков его цвет? Что происходит с осадком при стоянии на воздухе? Объяснить его изменение. Написать уравнения реакций. (II) прибавить раствор сульфида аммония. Что выпадает в осадок? Каков его цвет? Что происходит с осадком при стоянии на воздухе? Объяснить его изменение. Написать уравнения реакций.б) Насыпать в пробирку немного оксида свинца (IV) или сурика 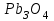 , прибавить 2—3 мл концентрированной , прибавить 2—3 мл концентрированной 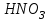 и 1—2 капли раствора сульфата марганца. Смесь нагреть до кипения. После отстаивания отметить цвет раствора. Написать уравнение реакции. Эта реакция используется в аналитической химии для качественного определения соединений марганца. и 1—2 капли раствора сульфата марганца. Смесь нагреть до кипения. После отстаивания отметить цвет раствора. Написать уравнение реакции. Эта реакция используется в аналитической химии для качественного определения соединений марганца.Какие свойства в опытах а) и б) проявляют соли 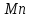 (II)? (II)?Опыт № 3. Свойства перманганата калия а) Разложение перманганата калия при нагревании. Нагреть в пробирке небольшое количество кристаллов перманганата калия. Доказать, какой выделяется газ. Продолжать нагревание до прекращения его выделения. После охлаждения растворить содержимое пробирки в небольшом количестве воды. Какой цвет имеют полученный раствор и осадок? Написать уравнение реакции. б) Окислительные свойства перманганата калия. В три пробирки налить по 1—2 мл раствора перманганата калия и немного разбавленной 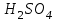 . В первую пробирку добавить раствор . В первую пробирку добавить раствор 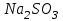 , во вторую — раствор , во вторую — раствор 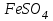 , в третью — раствор щавелевой кислоты (третью пробирку нагреть). Что наблюдается? Написать уравнения реакций в молекулярной и ионной формах. , в третью — раствор щавелевой кислоты (третью пробирку нагреть). Что наблюдается? Написать уравнения реакций в молекулярной и ионной формах.К 1—2 мл раствора 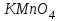 добавить воду и затем раствор сульфита натрия. Что происходит? Написать уравнение реакции в молекулярной и ионной формах. добавить воду и затем раствор сульфита натрия. Что происходит? Написать уравнение реакции в молекулярной и ионной формах.Налить в пробирку немного раствора 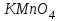 , добавить к нему концентрированный раствор щелочи, затем раствор сульфита натрия и взболтать. Отметить, как изменился цвет раствора. Затем наблюдать образование осадка. Написать уравнения реакций в молекулярной и ионной формах. , добавить к нему концентрированный раствор щелочи, затем раствор сульфита натрия и взболтать. Отметить, как изменился цвет раствора. Затем наблюдать образование осадка. Написать уравнения реакций в молекулярной и ионной формах.К раствору сульфата марганца (II) в пробирке добавлять по каплям раствор перманганата калия. Что происходит? Испытать реакцию раствора лакмусовой бумажкой. Написать уравнение реакции. Объяснить явления, наблюдаемые в опытах. Как влияет реакция среды на восстановление перманганата калия? в) Влияние кислотности среды на скорость окисления. Налить в две пробирки по 2—3 мл раствора 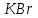 и добавить поровну в первую - пробирку разбавленной и добавить поровну в первую - пробирку разбавленной 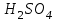 , во вторую — разбавленной , во вторую — разбавленной 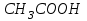 . Добавить в каждую пробирку по 10—15 капель раствора . Добавить в каждую пробирку по 10—15 капель раствора 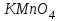 . Отметить, одновременно ли наблюдается исчезновение окраски в обеих пробирках. Как влияет кислотность среды на скорость окисления перманганатом калия? Написать уравнения реакций в молекулярной и ионной формах. . Отметить, одновременно ли наблюдается исчезновение окраски в обеих пробирках. Как влияет кислотность среды на скорость окисления перманганатом калия? Написать уравнения реакций в молекулярной и ионной формах.Контрольные вопросы: Какова максимальная ковалентность марганца? Какие степени окисления проявляет марганец в соединениях? Какие из них для него наиболее характерны? Привести примеры соединений марганца в различных степенях окисления и дать им названия. Как действуют на марганец разбавленные и концентрированные растворы 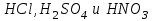 на холоду и при нагревании? Написать уравнения реакций. на холоду и при нагревании? Написать уравнения реакций. |
