цАМФ. Механизм действия
 Скачать 177.46 Kb. Скачать 177.46 Kb.
|
|
БИОСИНТЕЗ Нуклеотид цАМФ (3′,5′-циклоаденозинмонофосфат, сАМР) синтезируется мембранными аденилатциклазами — семейством ферментов, катализирующих реакцию циклизации АТФ (АТР) с образованием цАМФ и неорганического пирофосфата. Расщепление цАМФ с образованием АМФ (АМР) катализируется фосфодиэстеразами, которые ингибируются при высоких концентрациях метилированных производных ксантина, например кофеином. Активность аденилатцикпазы контролируется G-белками, которые в свою очередь сопряжены с рецепторами третьего типа, управляемыми внешними сигналами. Большинство G-белков (Gs-белки) активируют аденилатциклазу, некоторые G-белки её ингибируют (Gi-белки). Некоторые аденилатцикпазы активируются комплексом Са2+/кальмодулин. МЕХАНИЗМ ДЕЙСТВИЯ ц 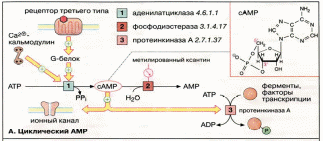 АМФ является аллостерическим эффектором протеинкиназ А (ПК-А) и ионных каналов. В неактивном состоянии ПК-A является тетрамером, две каталитические субъединицы (K-субъединицы) которого ингибированы регуляторными субъединицами (Р-субъединицы) (аутоингибирование). При связывании цАМФ Р-субъединицы диссоциируют из комплекса и K-единицы активируются. Фермент может фосфорилировать определённые остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков. АМФ является аллостерическим эффектором протеинкиназ А (ПК-А) и ионных каналов. В неактивном состоянии ПК-A является тетрамером, две каталитические субъединицы (K-субъединицы) которого ингибированы регуляторными субъединицами (Р-субъединицы) (аутоингибирование). При связывании цАМФ Р-субъединицы диссоциируют из комплекса и K-единицы активируются. Фермент может фосфорилировать определённые остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков. |
