Объект изучения – явления, связанные с изменением внутренней энергии Используемая модель – идеальный газ (нет взаимодействия между молекулами)
|
М.К.Т.
|
Термодинамика (P, V, T, m (ρ)) – основные параметры
|
Газовые законы
|
Изопроцессы
|
Основные величины
|
Основные величины
|
Основные законы
|
T = const
|
P = const
|
V = const
|
|
m0 = μ / NA = m / N
μ = Mr * 10-3 кг
 моль моль
ν = N / NA = m / μ

υкв = √ υ2
|
- масса молекулы
- масса моля
(μ H2O = 18*10-3 кг )
 моль моль
- количество вещества (моль)
- скорость средняя
квадратичная
|
P – давление
V – объем
T – температура
(N –количество
штук)
m - масса
(m = ρ V)
|
Па = Н/м2
м3 = 103л =
106 см3
10С = 1 К
1 кг = 103 г
|
Ур-е Менделеева- Клапейрона
PV = ν R T
(P ∆V = νR∆T)
P V = const V = const
T
  P1 V1 = P2 V2 P1 V1 = P2 V2
T1 T2
|
ν = m / μ
const = m R
 μ μ
если
m = const
|

PV = const
|

V = const = const
T
|
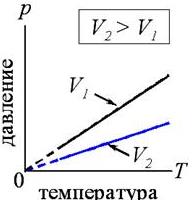
P = const = const
T
|

без теплообмена
|
Основные законы
|
Следствия,
пояснения
|
I закон термодинамики
|
изотермический
|
изобарный
|
изохор
ный
|
адиабат
ный
|
Основные величины
|
Основные законы
|
p = n mo υ2 = n mo υ2
3
p = 2 n Eк = 2 n Eк
3
p = ρ υ2 = ρ υ2
3
p = n k T
p = p1 + p2 смеси
 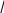
υкв = N1 υ12 + N2 υ22
 √ N1 + N2 √ N1 + N2
|
n = N / V
Eк = mo υ2 = 3 k T
  2 2 2 2
ρ = n mo = m = n mo = m
V
T = t0C + 273
 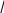
υкв = 3 k T
 √ mo √ mo
|
U = 3(5) ν R T = 3(5) ν R T
2
∆U = 3(5)νR∆ T
 2 2
A' = p ∆V
Q = cm∆t0
(∆t0 = t02 – t01)
Q = λ m
Q = L m
Q = q m
|
-внутренняя энергия
-работа газа
(A = - A')
-количество теплоты:
(нагревание, охлаждение)
-плавление
-испарение
-горение
|
∆U = Q + A
Q = ∆U + A'
Теплообмен самопроизвольно происходит только от более нагретого тела к менее нагретому
|
I закон термодинамики
II закон термодинамики
|
∆U = 0
Q = A'
или
A = -Q
|
∆U = Q + A
Q = ∆U +A'
Подмена
A = p ∆V = ν R ∆T = (2/3) ∆U
Или
∆ U=3νR∆T U=3νR∆T
2
= (3/2) A
|
А = 0
Q = ∆U
|
Q = 0
∆U = A
или
A' =-∆U
|
Постоянные
|
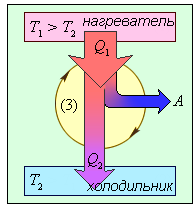
Тепловые двигатели
|
Влажность воздуха
|
Принцип действия
|
Основные законы
|
NA = 6,02*1023
1/моль
k = 1,38*10-23 Дж/К
R = NA*k = 8,31 Дж
 К моль К моль
|
- число Авогадро
- постоянная
Больцмана
- универсальная
газовая
постоянная
|
|
ή = T1 – T2
 T1 T1
ή = Q1 – Q2= Aп
  Q1 Q1 Q1 Q1
Q1 – Q2 = Aп
|
КПД
- идеального
теплового
двигателя
- реального
- полезная
работа
|
φ = p1100%
 p0 p0
p0 = n k T – не зависит от объема пара, а только от t0 (излишки конденсируются)
|
φ – относительная влажность
p0 –давление насыщенных паров при данной t0
p1 –давление реальных паров при данной t0 (становится p0 при «точке росы»)
|
 Скачать 0.91 Mb.
Скачать 0.91 Mb.