реферат. Реферат молекулярная физика и термодинамика проверил москва 2017
 Скачать 0.99 Mb. Скачать 0.99 Mb.
|
    ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ УНИВЕРСИТЕТ ТРАНСПОРТА (МИИТ)» Кафедра «Физика» РЕФЕРАТ МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА Выполнил: Проверил: МОСКВА 2017 ПЛАН 1. Агрегатные состояния вещества. Уравнение состояния идеального газа. Закон Дальтона. Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объема насыщенного пара. Влажность воздуха. 2. Основное уравнение молекулярно-кинетической теории газов. Закон равнораспределения энергии по степеням свободы. 3. Распределение молекул по скоростям (распределение Максвелла). Опыт Штерна. Барометрическая формула. Распределение Больцмана для частиц во внешнем поле. Распределение Максвелла-Больцмана. 4. Внутренняя энергия идеального газа. Первое начало термодинамики. Теплоемкость (удельная и молярная). Изопроцессы. Адиабатический процесс, уравнение Пуассона. Работа, совершаемая газом при различных процессах. 5. Реальные газы. Уравнение Ван-дер-Ваальса. Энтропия. Энтропия и термодинамическая вероятность. Равновесные процессы. Обратимые процессы. Циклы. 6. Второе начало термодинамики. К.П.Д. тепловой машины. Цикл Карно. К.П.Д. цикла Карно. Система с изменяющимся числом частиц, химический потенциал. 7. Диффузия. Теплопроводность. Вязкость.
Перед тем, как говорить об Агрегатных состояниях - нужно выяснить, а что такое, непосредственно, само вещество. Вещество – это совокупность частиц, которые связанны между собой химическими связями и находящиеся при определенных условиях в одном из агрегатных состояний. Любое вещество состоит из совокупности очень большого числа частиц: атомов, молекул, ионов, которые могут объединяться между собой в ассоциаты, называемые также агрегатами или кластерами. От температуры и поведения частиц в ассоциатах зависит то, в каком из двух основных агрегатных состояний будет находится вещество-кристаллическом или газообразном, и в переходных-аморфном, жидкокристаллическом, жидком и парообразном. Твердое, жидкокристаллическое и жидкое агрегатные состояния являются конденсированными, а парообразное и газообразное – сильно разряженными. Совокупностью однородных микрообластей, характеризующихся одинаковой упорядоченностью и концентрацией частиц и заключенных в макроскопическом объеме вещества, ограниченном поверхностью раздела, называется фаза. Фаза характерна только для веществ, находящихся в кристаллическом и газообразном состояниях, т.к. это однородные агрегатные состояния. А Метафаза , в свою очередь, это совокупность разнородных микрообластей, отличающихся друг от друга степенью упорядоченности частиц или их концентрацией и заключенных в макроскопическом объеме вещества, ограниченном поверхностью раздела. В таком понимании метафаза характерна только для веществ, находящихся в неоднородных переходных агрегатных состояний. Разные фазы и метафазы могут смешиваться друг с другом, получая при этом одно агрегатное состояние, и тогда поверхность раздела между ними исчезает . Часто границу между понятиями «основное» и «переходное» агрегатные состояния. Понятия «агрегатное состояние», «фаза» и «меофаза» часто используют как синонимы. Целесообразно рассматривать пять возможных агрегатных состояний: твердое, жидкокристаллическое, жидкое, парообразное, газообразное. Переход одной фазы в другую - есть фазовый переход. Они бывают первого и второго рода. Фазовые переходы первого рода наблюдаются при переходе из одного агрегатного состояния в другое агрегатное состояние. Для них характерно: - скачкообразное изменение физических величин, описывающих состояние вещества ( объем, плотность, вязкость и т.д.); - своя температура, при которой совершается данный фазовый переход - своя теплота, характеризующая данный переход, т.к. рвутся межмолекулярные связи. Фазовые переходы второго рода наблюдаются при изменении упорядоченности частиц в пределах одного агрегатного состояния, для них характерно: - постепенное изменение физических свойств вещества; - изменение упорядоченности частиц вещества под действием градиента внешних полей или при определенной температуре, называемой температурой фазового перехода; - теплота фазовых переходов второго рода равна или близка к нулю. Главным различиеи фазовых переходов первого и второго рода является то, что при переходах первого рода, прежде всего, изменяется энергия частиц системы, а при переходах второго рода – упорядоченность частиц системы. Переходом вещества из твердого состояния в жидкое называется плавлением и характеризуется температурой плавления. Переходом вещества из жидкого в парообразное состояние называется испарением и характеризуется температурой кипения. Для некоторых веществ с небольшой молекулярной массой и слабым межмолекулярным взаимодействием возможен непосредственный переход из твердого состояния в парообразное, минуя жидкое. Такой переход называется сублимацией. У перечисленных процессов возможен переход в обратном направлении: тогда они называются замерзанием, конденсацией, десублимацией. Вещества, которые не разлагаются при плавлении и кипении, могут находиться во всех четырех агрегатных состояниях, но в зависимости от температуры и давления. 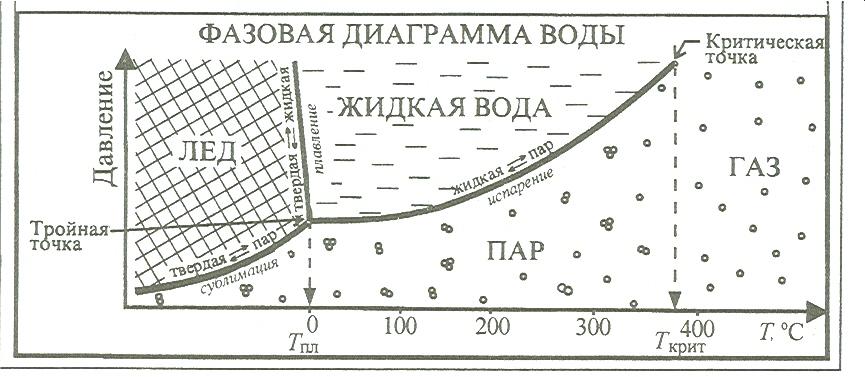 Твердое состояние При достаточно низких температурах практически все вещества находятся в твердом состоянии. В данном состоянии расстояние между частицами вещества сопоставимы с размерами самих частиц, что обеспечивает их сильное взаимодействие и значительное преобладание у них потенциальной энергии над кинетической. Движение частиц твердого вещества ограничено только незначительными колебаниями и вращениями относительно занимаемого положения, а поступательное движение у них отсутствует. Это приводит к внутренней упорядоченности в расположении частиц. Следовательно для твердых тел характерна собственная форма, механическая прочность, постоянный объем. Твердые вещества имеют разделение на кристаллические и аморфные. Данное разделение зависит от степени упорядоченности частиц. Для кристаллических веществ характерен порядок в расположении всех частиц. Их твердая фаза состоит из частиц, которые образуют однородную структуру, характеризующуюся строгой повторяемостью одной и той же элементарной ячейки во всех направлениях. Элементарная ячейка кристалла характеризует его кристаллическую решетку. Классификация кристаллической решетки зависит от типа частиц, которые составляют кристалл, и от природы сил притяжения между ними. 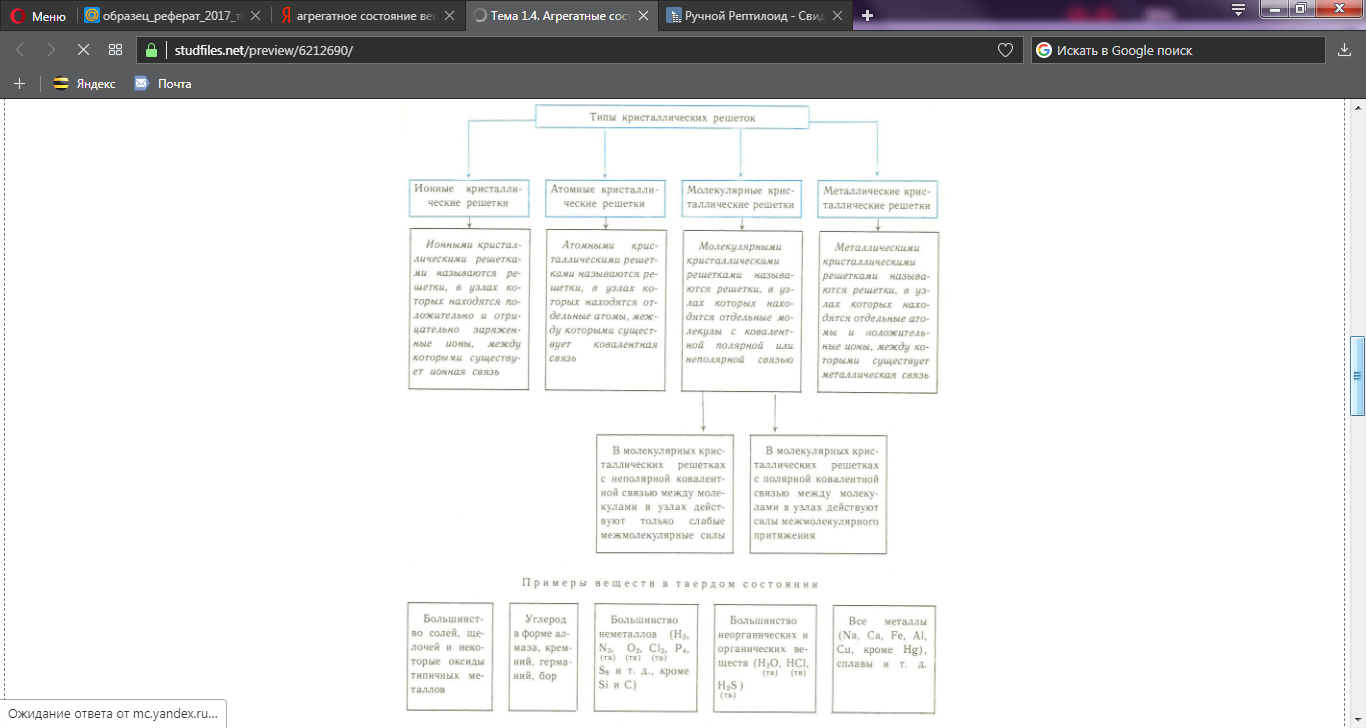 Многие кристаллические вещества в зависимости от условий могут иметь разную кристаллическую структуру. Это явление называется полиморфизмом. Аморфные вещества. Данное состояние характерно для полимеров. Длинные молекулы с легкостью изгибаются и переплетаются с другими молекулами, из-за чего образуется нерегулярность в расположении частиц. Отличие аморфных частиц от кристаллических: - изотропия – одинаковость физических и химических свойств тела или среды по всем направлениям. -отсутствие фиксированной температуры плавления. Аморфные вещества менее устойчивы, чем кристаллические, и поэтому любое аморфное тело со временем может перейти в энергетически более устойчивое состояние – кристаллическое. Жидкое состояние При повышении температуры энергия тепловых колебаний частиц возрастает, и для каждого вещества имеется температура, начиная с которой энергия тепловых колебаний превышает энергию связей. Частицы могут совершать различные движения, смещаясь относительно друг друга. Они продолжают контактировать, но при этом правильная геометрическая структура частиц нарушается – вещество существует в жидком состоянии. Из-за подвижности частиц для жидкого состояния характерны броуновское движение, диффузия и летучесть частиц. Важным свойством жидкости является вязкость, что, в свою очередь, характеризует межассоциатные силы, которые препятствующие свободному течению жидкости. Жидкости занимают промежуточное положение между газообразным и твердым состоянием. Они имеют более упорядоченная структура, чем газ, но менее чем твердое вещество. Парообразное и газообразное состояния. Парообразное и газообразное состояние обычно не различают. Газ – это сильно разряженная однородная система, состоящая из отдельных молекул, далеко отстоящих друг от друга, которую можно рассматривать как единую динамическую фазу. Пар - это сильно разряженная неоднородная система, представляющая собой смесь молекул и неустойчивых небольших ассоциатов, состоящих из этих молекул. Молекулярно-кинетическая теория объясняет свойства идеального газа, основываясь на следующих положениях: молекулы совершают непрерывное беспорядочное движение; объем молекул газа пренебрежимо мал по сравнению с межмолекулярными расстояниями; между молекулами газа не действуют силы притяжения или отталкивания; средняя кинетическая энергия молекул газа пропорциональна его абсолютной температуре. Вследствие незначительности сил межмолекулярного взаимодействия и наличия большого свободного объема для газов характерны: высокая скорость теплового движения и молекулярной диффузии, стремление молекул занять больший объем, насколько это возможно, а также большая сжимаемость. Изолированная газофазная система характеризуется четырьмя параметрами: давлением, температурой, объемом, количеством вещества. 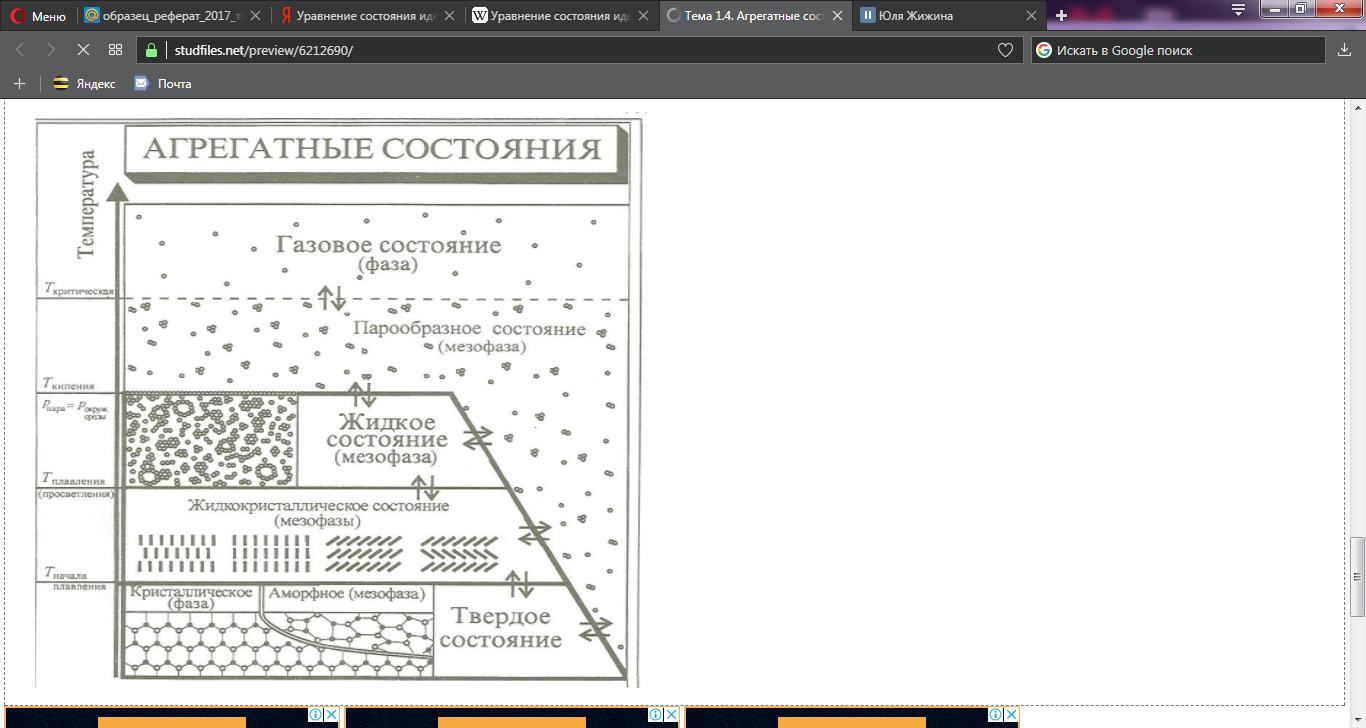
Связь между параметрами изолированной газофазной системы описывается уравнением состояния идеального газа: 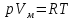 R-универсальная газовая постоянная; R=[Дж/моль] 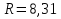 Дж/(моль*К) Дж/(моль*К)p-давление; p=[Па] 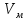 -объём; -объём; 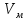 =[л] =[л]T-абсолютная температура; T=[К]
Чаще имеют дело не с чистым газом, а со смесью газов. Атмосферный воздух, в частности, представляет собой смесь азота, кислорода и многих других газов. Каждый из газов смеси вносит свой «вклад» в суммарное давление на стенки сосуда. Давление, которое имел бы каждый из газов, составляющих смесь, если удалить из сосуда остальные газы, называют парциальным давлением. Давление смеси газов р равно сумме парциальных давлений всех газов р1, р2, р3... 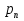 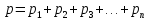 Данное соотношение называют законом Дальтона. С точки зрения молекулярно-кинетической теории закон Дальтона выполняется потому, что взаимодействие между молекулами идеального газа пренебрежимо мало. Поэтому каждый газ оказывает на стенку сосуда такое давление, как если бы остальных газов не было. Экспериментально установлено, что моль любого газа при нормальных условиях занимает объем 22,4 л. В смеси газов каждый из них оказывает давление на стенки сосуда независимо от присутствия других газов. 1.4. Насыщенные и ненасыщенные пары. Для того, чтобы говорить о насыщенных и ненасыщенных парах, нужно ответить на вопрос: А что такое сам пар, парообразование и за счёт чего он образуется. Переход вещества из твёрдого или жидкого состояния в газообразное называется парообразованием, а совокупность молекул вещества, покинувших поверхность жидкости или твёрдого тела, называется паром этого вещества. Чаще всего под парообразованием понимается переход вещества из жидкого состояния в газообразное. Парообразование, происходящее из твёрдого состояния, называется возгонкой или сублимацией. Парообразование из жидкого состояния разделяют на2 вида: испарение и кипение. Испарение – это парообразование, происходящее при любой температуре только со свободной поверхности жидкости в воздух или вакуум, сопровождающееся понижением температуры жидкости. Обратный процесс называется конденсацией. Кипение – это парообразование, происходящее и с поверхности, и во всём объёме жидкости при постоянной температуре. Рассмотрим два сосуда с жидкостью – один открытый, второй закрыт крышкой. В обоих сосудах происходит и испарение жидкости, и конденсация пара. Но в сосуде под номером один, испарение преобладает над конденсацией, потому что молекулы жидкости имеют возможность покинуть пределы сосуда и в жидкость они не возвратятся, а на их место с поверхности жидкости в воздух выходят другие молекулы. Число молекул N1, покидающих поверхность за 1с, превышает число молекул N2, возвращающихся обратно. Если процесс испарения преобладает над процессом конденсации, то образующийся пар называется ненасыщенным. В сосуде номер два, что плотно закрыт крышкой, вначале число молекул N1, покидающих поверхность за 1с, превышает число молекул N2, возвращающихся обратно. Поэтому плотность пара над поверхностью жидкости и его давление возрастают. Но чем больше плотность и давление, тем больше количество молекул, возвращающихся в жидкость в течение 1с. Через некоторое время скорости испарения и конденсации становятся одинаковыми, т.е. количество вылетевших из жидкости молекул N1 равно количеству возвратившихся N2. Это означает, что между паром и его жидкостью установилось динамическое равновесие. Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным. 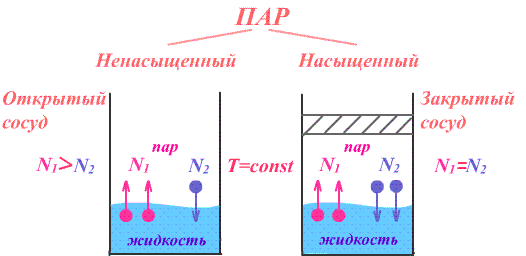 1.5 Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объема насыщенного пара. 1.Давление и плотность насыщенного пара постоянны и не зависят от объёма пространства над испаряющейся жидкостью. Для идеального газа давление и плотность уменьшаются с ростом объёма.(слева насыщенный газ, справа идеальный) 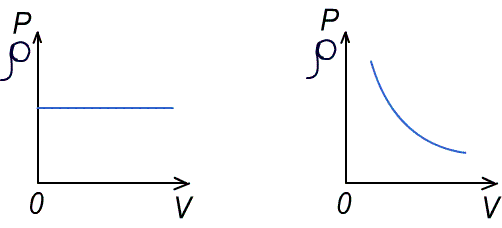 2.С увеличением температуры при неизменном объёме рост давления насыщенного пара происходит не по линейного закону, как для идеального газа, а гораздо быстрее. Это объясняется тем, что увеличение давления происходит не только за счёт увеличения кинетической энергии, но и за счёт увеличения количества испарившихся молекул. По этой же причине возрастает и плотность насыщенного пара. 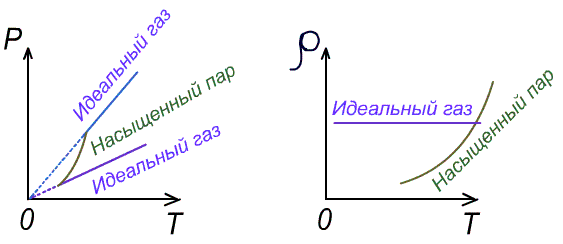 3.Давление и плотность насыщенного пара зависят от рода жидкости и определяются теплотой парообразования. Чем меньше теплота парообразования, тем больше давление и плотность насыщенного пара. 1.6. Влажность воздуха. 1.Атмосфера. Атмосфера – это газообразная оболочка Земли, состоящая, в основном, из азота (>75%), кислорода (<15%) и других газов. Примерно 1% атмосферы приходится на водяной пар. Воздух называется влажным, если в нём присутствует водяной пар. От количества водяных паров, содержащихся в воздухе, зависит погода, самочувствие человека, проведение технологических процессов на производстве, сохранность экспонатов в музее, сохранность зерна в хранилищах. Из этого следует, насколько важно контролировать степень влажности воздуха и умение, при необходимости, изменять её в помещении. 2.Абсолютная влажность. Абсолютная влажность воздуха-это количество водяного пара, содержащегося в 1 м3 воздуха (плотность водяного пара, кг/ 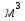 ). ).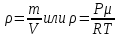 , где , гдеm – масса водяного пара, [m]=кг, V – объём воздуха, в котором содержится водяной пар, [V]= 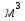 , Р – парциальное давление водяного пара, [P]=Па, μ– молярная масса водяного пара,[μ]=г/моль Т – его температура, [T]=К , Р – парциальное давление водяного пара, [P]=Па, μ– молярная масса водяного пара,[μ]=г/моль Т – его температура, [T]=КТак как плотность пропорциональна давлению, то абсолютную влажность можно характеризовать и парциальным давлением водяного пара. 3.Относительная влажность. На степень влажности или сухости воздуха влияет не только количество водяных паров, содержащихся в нём, но и температура воздуха. Даже если количество водяного пара одинаково, при более низкой температуре воздух будет казаться более влажным. Поэтому в холодном помещении возникает ощущение сырости. Это объясняется тем, что при более высокой температуре в воздухе может содержаться большее максимальное количество водяного пара, а максимальное количество водяного пара в воздухе содержится тогда, когда пар насыщенный. Поэтому, максимальное количество водяного пара, которое может содержаться в 1м3 воздуха при данной температуре, называется плотностью насыщенного пара при данной температуре. Зависимость плотности и парциального давления насыщенного пара от температуры можно найти в физических таблицах. |
