Методические рекомендации по работе с литературой Методические рекомендации по подготовке доклада
 Скачать 1.81 Mb. Скачать 1.81 Mb.
|
|
Раздел 1. Строение и свойство белков Белки - это высокомолекулярные соединения (полимеры), состоящие из -аминокислот - мономерных звеньев, соединенных между собой пептидными связями. Все 20 аминокислот, встречающиеся в белках, это -аминокислоты, общим признаком которых является наличие аминогруппы - NН2 и карбоксильной группы - СООН у -углеродного атома. -аминокислоты отличаются друг от друга структурой группы R и, следовательно, свойствами. Пептидные связи образуются при взаимодействии -аминогруппы одной аминокислоты с -карбоксильной группой другой аминокислоты: Пептидная связь - это амидная ковалентная связь, соединяющая аминокислоты в цепочку. Следовательно, пептиды - это цепочки аминокислот. Полипептидная цепь имеет определенное направление, так как у неё разные концы - либо свободная -аминогруппа (N-конец), либо свободная -карбоксильная группа (С-конец) Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают уровни конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN. Третичная структура глобулярных белков представляет ориентацию в пространстве полипептидной цепи, содержащей -спирали, -структуры и участки без периодической структуры (беспорядочный клубок). Дополнительное складывание скрученной полипептидной цепи образует компактную структуру. Это происходит, прежде всего, в результате взаимодействия между боковыми цепями аминокислотных остатков. Существует несколько видов взаимодействия между R-группами, в основном нековалентного характера: Связи, стабилизирующие третичную структуру:
Доменные белки содержат обособленные глобулы - домены, образованные одной и той же пептидной цепью. Денатурация Белковая молекула имеет нативную (функциональную) конформацию благодаря наличию большого числа слабых связей и быстро денатурирует при изменении условий среды, от которых эти силы зависят. Изменение температуры, ионной силы, рН, а также обработка органическими или некоторыми дестабилизирующими агентами может привести к нарушению нативной конформации, что и называется денатурацией. Денатурирующие вещества образуют связи с аминогруппами или карбонильными группами пептидного остова или некоторыми боковыми остатками аминокислот, подменяя собственные внутримолекулярные связи в белке, вследствие чего вторичная и третичная структуры изменяются. Эти изменения не затрагивают первичную структуру, при этом биологическая активность белка утрачивается. Ренативация При определенных условиях денатурированный белок может быть ренативирован. Это происходит при удалении денатурирующего или дестабилизирующего фактора. Например, при удалении мочевины диализом полипептиды самопроизвольно восстанавливают свою нативную конформацию. То же происходит при медленном охлаждении денатурированного нагреванием белка. Основным свойством белка, обеспечивающим его функцию, является избирательное взаимодействие с определенным веществом - лигандом. Лигандами могут быть вещества разной природы, как низкомолекулярные соединения, так и макромолекулы, в том числе и белки. На белковых молекулах есть участки, к которым присоединяется лиганд - центры связывания или активные центры. Центры связывания формируются из аминокислотных остатков, сближенных в результате формирования вторичной и третичной структуры. Связи между белком и лигандом могут быть нековалентными и ковалентными. Высокая специфичность взаимодействия («узнавания») белка и лиганда обеспечивается комплементарностью структуры центра связывания пространственной структуре лиганда. Под комплементарностью понимают химическое и пространственное соответствие активного центра белка и лиганда. Простые и сложные белки Если белки кроме пептидных цепей содержат еще компоненты неаминокислотной природы, то такие белки называются сложными. Небелковую часть называют простетической группой, а белковую апопротеином. Сложный белок холопротеин может диссоциировать на компоненты: Холопротеин ↔ апопротеин + простетическая группа. Направление реакции зависит от прочности связи компонентов холопротеина. Простетической группой могут быть органические вещества, ионы металлов, нуклеиновые кислоты, углеводы, липиды и др. вещества. Задачи по разделу 1. «Строение и свойства белков»
А. При анализе N-концевой аминокислоты и аминокислотного состава пептида получено: фен- (лиз, глу, про). Б. После гидролиза трипсином (расщепляет пептидные связи, в образовании которых участвуют карбоксильные группы лиз и арг) образуется трипептид, содержащий лиз, фен, про. 2. Кривые насыщения гемоглобина кислородом в крови матери и плода сильно различаются. % насыщение Hb кислородом  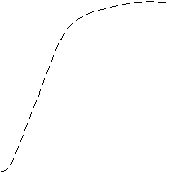 2 2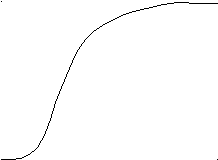  1  00% 00% 1  50% 50%      20 40 60 80 100 парциальное давление О2 1 - насыщения гемоглобина кислородом в крови матери 2 - насыщения гемоглобина кислородом в крови ребенка Это явление обусловлено присутствием в эритроцитах плода HbF (α2 γ2), который по своей структуре отличается от HbА (α2 β2), содержащегося в эритроцитах матери. Рассмотрев рисунок, ответьте на вопросы: а) какой гемоглобин обладает при физиологических условиях более высоким сродством к кислороду - HbА или HbF? б) какое физиологическое значение имеет тот факт, что HbА и HbF обладают разным сродством к кислороду (учитывая, что кровь матери и плода не смешиваются)? 3. В результате мутаций в гене α-цепи гемоглобина А вместо Гис, входящего в состав активного центра, находится Тир. Это приводит к тому, что Fe2+ окисляется до Fe3+. Какова причина развития гемоглобинопатии при данном наследственном заболевании? Для ответа на поставленный вопрос объясните: а) как называется такая форма гемоглобина; б) какую роль играют остатки Гис, входящие в состав активного центра, в функционировании гемоглобина; в) сколько молекул О2 способен переносить в ткани такой гемоглобин и какова функция кислорода в тканях. 4. В крови студента одной из африканских стран, поступившего в больницу по поводу одышки, головокружения, учащенного сердцебиения и болей в конечностях, при анализе крови были найдены эритроциты, имеющие форму серпа. Объясните причину развития данного заболевания. Для ответа на этот вопрос объясните: а) какое строение имеет гемоглобин А; б) какие изменения в структуре белка привели к образованию патологической формы гемоглобина; в) как называется такая форма гемоглобина; г) почему изменяется форма и функция эритроцитов? 5. При длительных умеренных тренировках (например, бег трусцой в течение 30 мин) в сердечной мышце увеличивается количество шаперонов - 70 (называемых также белками теплового шока). Почему тренированные таким образом люди значительно легче переносят последствия тромбозов коронарных сосудов (инфарктов)? Для ответа на этот вопрос объясните: а) какое строение имеют эти белки; б) какую роль они играют в поддержании нативной конформации других белков. 6. Дитилин, структурная формула которого приводится ниже, используется в качестве миорелаксанта для расслабления скелетных мышц на время операции. На чем основан механизм лекарственного действия препарата? При ответе объясните: 1) как проводится импульс через нервно-мышечный синапс; 2) какое вещество используется в качестве нейромедиатора в данном типе синапсов; 3) каков механизм действия препарата, если сравнить строение дитилина и нейромедиатора.  СН3 СН3СН3 — N+—CH2—CH2—O—C—CH3 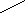 СН3 ║ СН3 ║O Ацетилхолин 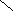  СН3 СН3 СН3 СН3 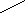  СН3—N+—СН2—СН2—О-С—СН2—СН2—С-О—СН2—СН2-N+-СН3 СН3 ║ ║ СН3 СН3—N+—СН2—СН2—О-С—СН2—СН2—С-О—СН2—СН2-N+-СН3 СН3 ║ ║ СН3О О Дитилин 7. После высаливания искомого белка сульфатом аммония получен осадок, содержащий изучаемый белок вместе с солью. Как можно отделить белок от соли? Для ответа объясните: а) с помощью каких методов можно удалить низкомолекулярные примеси из осадка; б) какие принципы лежат в основе каждого метода; в) какой из методов используется, если нужно сохранить исходный объем белкового раствора. 8. Не зря ли мучают диабетиков, вводя им инсулин инъекцией, не проще ли вводить его внутрь за 40 мин до еды? 9. В состав белков пищи, которую скармливали животным входили пептиды следующего состава: 1 2 3 4 5 6 7 8 9 Ала—Сер—Гли—Тир—Гис—Фен—Лиз—Три—Вал—Лей. А. Назовите ферменты (и номер соответствующей связи), которые расщепляют эти пептиды:
Б. Назовите продукты, которые образуются в результате совместного действия ферментов, и укажите их дальнейшую судьбу. 10. В результате мутации в гене β-цепи гемоглобина, в гидрофобном «кармане», где происходит связывание белковой части с гемом, Фен заменен заменен на Сер. Каков механизм развития гемоглобинопатии? Для ответа на этот вопрос объясните: а) какую роль играют гидрофобные аминокислоты «кармана», где расположен гем, в функционировании гемоглобина; б) почему кислород легко проходит в активный центр и связывается с железом гема, а вода – нет; в) почему такая замена приводит к нарушению связывания с кислородом; сколько молекул О2 может связать такой мутантный белок. 11. Взаимодействие нейромедиатора ацетилхолина с М-холинорецепторами вызывает сокращение гладких мышц внутренних органов (кишечника и желудка, желчного и мочевого пузырей, бронхов), а также сужение зрачков. Атропин – лекарственный препарат, используемый в фармакологии как спазмолитик, т.е. вещество снимающее спазм гладких мышц. Каков механизм действия атропина? Для ответа: а) объясните, как проводится нервный импульс через синапс; б) сравните структуру нейромедиатора и лекарства, найдите сходство в структуре этих веществ; 12. Желудочный сок содержит большое количество соляной кислоты, одна из функций которой – денатурация поступающих с пищей белков. Какое значение имеет денатурация пищевых и бактериальных белков в желудке для их переваривания и защиты организма от патогенных микроорганизмов, поступающих с пищей и водой? При ответе: а) представьте схемы строения всех уровней структурной организации белков и дайте определения термину «нативный белок»; б) укажите связи, которые разрывают протеолитические ферменты в процессе переваривания белков; в) объясните влияние низкого значения рН (1,5) желудочного сока на конформацию белков, поступающих с пищей. 13. У альпиниста при восхождении на высоту 3500 м проявились признаки гипоксии: головная боль, учащённое дыхание, тошнота и усиленное сердцебиение. Через два дня отдыха в лагере на той же высоте состояние значительно улучшилось. Известно, что адаптация к гипоксии происходит за счёт изменения концентрации 2,3 – БГФ. Объясните, как изменяется в этих условиях его концентрация в эритроцитах и как этот лиганд влияет на поступление кислорода в ткани при сниженном парциальном давлении кислорода в атмосфере. Назовите белок крови, доставляющий кислород в ткани, и опишите особенности его строения. Тестовые задания по разделу 1. «Строение и свойства белков»
б) Какие из перечисленных ниже цветных реакций будут положительными с данным пептидом?
2 А. Асн. Б. Гли. В. Ала. Г. Глу. Д. Лиз. . Установите соответствие: 1. Аминокислота, образующая ионную связь с Асп 2. Аминокислота, располагающаяся внутри цитозольного глобулярного белка 3. Аминокислота, не имеющая радикала. 3. С помощью какой реакции можно определить присутствие в растворе любого белка? а) биуретовой; б) ксантопротеиновой; в) нингидриновой; г) с фенилизотиоционатом; д) Фоля. 4. В полипептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, способных образовывать связи и укажите тип этих связей. Сер, асн. 3. Глу, асп. 5. Гис, асп. 7. Цис, ала. Ала, вал. 4. Цис, цис. 6. Фен, арг. 8. Глу, лиз. 5. Какие из перечисленных ниже взаимодействий обусловлены комплементарностью молекул? 1) белка с лигандом; 2) протомеры в олигомерном белке; 3) белка с диполями воды в растворе; 4) функционально связанные ферменты при формировании полиферментных комплексов; 5) различные белки в процессе самосборки клеточных органелл; 6) радикалы аминокислот при формировании третичной структуры белка. 6. Что представляют собой контактные поверхности протомеров в олигомерном белке? А. Поверхностные участки протомеров, между аминокислотными остатками которых образуются преимущественно ковалентные связи. Б. Поверхностные участки протомеров, комплементарные друг другу. В результате геометрического и химического соответствия между двумя взаимодействующими поверхностями образуется большое количество слабых связей. В. Поверхностные участки протомеров, представленные только небелковыми группами, за счет которых осуществляется контакт взаимодействующих полипептидных цепей. Г. Фрагменты полипептидных цепей, уложенных в пространстве в виде β-структур. 7. Подберите к каждому лиганду белок, с которым он может взаимодействовать. 1) СО2 а) взаимодействует только с Нb; 2) О2 б) взаимодействует только с 3) 3-фосфоглицерат миоглобином; 4) Н+ в) взаимодействует с обоими 5) 2,3-бифосфоглицерат. белками; г) не взаимодействует ни с одним из них. 8. Какие общие закономерности подтверждаются сравнением первичной структуры Нb А и Нb S человека? 1) значительное совпадение первичной структуры разных белков, выполняющих сходные, но не одинаковые функции; 2) большое сходство белков, выполняющих у разных видов одну и ту же функцию; 3) влияние отдельных аминокислотных замен на функцию белка; 4) связь между эволюционной близостью видов и сходством первичной структуры белков, выполняющих одну и ту же функцию. 9. Выберите правильные ответы. Приобретенные протеинопатии развиваются вследствие: 1) изменения первичной структуры белка; 2) изменения конформации белков при изменении условий среды; 3) химической модификации белков; 4) изменения количества белков в органах и тканях; 5) появления в крови белков, находящихся там в норме в следовых количествах. 10. Денатурация белков – сложный процесс изменения нативной конформации молекулы. Что происходит при этом? 1) изменение нековалентных связей; 2) потеря способности взаимодействовать с природным лигандом; 3) уменьшение растворимости белка; 4) разрыв пептидных связей. 11. На различиях каких физико-химических свойств белков основаны методы разделения и выделения индивидуальных белков? 1) метод ультрацентрифугирования а) ионизация; 2) метод электрофореза б) гидратация; 3) метод гель-фильтрации в) молекулярная масса. 4) метод ионообменной хроматографии 5) метод солевого фракционирования. 12. При изучении свойств белков используются (наряду с другими) методы диализа и гель-фильтрации. В каком из перечисленных ниже процессов они находят свое применение? 1) очистка белков от низкомолекулярных соединений; 2) фракционирование высокомолекулярных белков по различию молекулярной массы; 3) разделение белков по суммарному заряду; 4) определение молекулярной массы. А. В диализе. В. В гель-фильтрации. С. В обоих методах. D. Ни в том ни в другом случае. 13. Выберите правильные ответы. Эндопептидазы отличаются от экзопептидаз тем, что: а) расщепляют любую пепитдную связь в белках; б) являются гидролазами; в) расщепляют пептидные связи, образованные ароматическими аминокислотами; г) секретируются всегда в активной форме; д) не расщепляют пептидные связи, образованные N –концевой и С – концевой аминокислотой. Раздел 2. Ферменты В живой клетке множество разнообразных соединений, но реакции между ними не беспорядочны, а образуют строго определенные метаболические пути, характерные для данной клетки. Индивидуальность клетки в большой степени определяется уникальным набором ферментов, который она генетически запрограммирована производить. Отсутствие даже одного фермента или какой-нибудь его дефект могут иметь очень серьезные отрицательные последствия для организма. Функции ферментов сводятся к ускорению химических реакций, причем ферменты отличаются от других катализаторов тремя уникальными свойствами:
Все ферменты относятся к глобулярным белкам, причем каждый фермент выполняет специфическую функцию, связанную с присущей ему глобулярной структурой. Однако активность многих ферментов зависит от небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой. Роль кофактора в основном сводится к следующему:
В этой роли обычно выступают органические коферменты. Их участие в реакции иногда сводится к тому, что они выступают как доноры или акцепторы определенных химических групп. Ингибиторы ферментов Действие ферментов можно полностью или частично подавить (ингибировать) определенными химическими веществами (ингибиторами). По характеру действия ингибиторы могут быть обратимыми и необратимыми. В основе этого деления лежит прочность соединения ингибитора с ферментом. Другой способ деления ингибиторов основывается на характере места их связывания. Одни из них связываются с ферментом в активном центре, а другие - в удаленном от активного центра месте. Они могут связывать и блокировать функциональную группу молекулы фермента, необходимую для проявления его активности. При этом они необратимо, часто ковалентно, связываются с ферментом или фермент - субстратным комплексом и необратимо изменяют нативную конформацию. Регуляция действия ферментов В живой клетке скорость ферментативных реакций находится под строгим контролем, что позволяет каждой метаболической цепочке реакций постоянно изменяться, приспосабливаясь к меняющимся потребностям клетки в продукте. В каждой метаболической цепи есть фермент, который задает скорость всей цепочке реакций. Он называется регуляторным ферментом. Существует несколько способов регуляции действия ферментов:
Основные способы регуляции активности ферментов Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование. «Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей. Регуляция активности ферментов путем фосфорилирования-дефосфорилирования . Фермент изменяет активность в результате ковалентной модификации. В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы. Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Этот процесс иногда начинается с ковалентной или нековалентной модификации одной из субъединиц. Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии cAMP (циклоаденозинмонофосфорная кислота), которая способна присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2 + 2cАМР → 2С + 2(R -сАМР) Циклический АМР является продуктом АТР, превращение которой катализирует фермент аденилатциклаза: АТР → с АМР + Н4Р2О7 Аденилатциклазная система. Аденилатциклаза и протеинкиназа катализируют взаимосвязанные реакции, которые составляют единую регуляторную систему. Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента энтеропептидазой. Отщепление определенных пептидных групп «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа. Нарушения структуры какого-либо фермента, ведущие к снижению его активности, приводят к нарушению метаболических путей, в которых участвует этот фермент. Такие нарушения почти всегда проявляются как болезни. Повреждения ферментов бывают двух типов: наследственные дефекты строения фермента и повреждения, вызванные попадающими в организм токсическими веществами, ингибирующими фермент. Задачи по разделу «Ферменты»
Фермент Активность, Е/л Щелочная фосфатаза 800 АЛТ 45 АСТ 33 Нарушение функции какого органа можно предположить у обследованного?
7. У ребенка 2 лет, перенесшего инфекционный энтерит, после еды появляются рвота, диарея, боли в животе. После исключения молока из пищи симптомы исчезли. Объясните возможную причину заболевания.
UDР + Галактозо-1-фосфат → UDР-галактоза + РРi. Каким образом происходит дальнейший метаболизм галактозы? Напишите схемы этих метаболических путей. 9. Амилаза – тканеспецифический фермент поджелудочной железы, участвующий в процессе пищеварения. А. Какую реакцию катализирует амилаза? Б. Какова амилазная активность в сыворотке крови и моче здорового человека? В. Как можно подтвердить диагноз острого панкреатита (воспаление поджелудочной железы)? 10. Для лечения двигательных нарушений после травм, параличей, полиомиелита используют препарат калимин, который по структуре похож на ацетилхолин. Как изменится концентрация ацетилхолина в нервно-мышечных синапсах после поступления нервного импульса при лечении калимином? А. Опишите влияние структурных аналогов субстратов на активность ферментов. Б. Напишите реакцию гидролиза ацетилхолина и объясните ее значение для проведения нервного импульса. 11. На чем основано действие аспирина как жаропонижающего средства, лекарства, снимающего слабые боли и уменьшающего воспалительные процессы ? А) напишите схему процесса, на который влияет аспирин; Б) укажите фермент, ингибитором которого является аспирин; В) в чем заключается причина изменения конформации молекул фермента при действии на нее аспирина, обратима ли инактивация фермента. 12. Несколько лет назад в токийском метро террористы распылили одно из самых сильных отравляющих веществ – зарин. Многие пассажиры потеряли сознание, некоторые умерли в результате остановки дыхания. На чем основано нервно-паралитическое действие зарина? а) активность какого фермента и как изменится в крови при отравлении этим веществом; б) напишите реакцию, скорость которой изменяет зарин. 13. В процессе переваривания пищевых белков в желудке главную роль играет фермент пепсин, который расщепляет пептидные связи, образованные аминогруппами таких аминокислот, как тирозин, фенилаланин и триптофан, внутри полипептидной цепи. Почему при атрофических гастритах нарушается переваривание белков в желудке? При ответе: а) напишите реакцию, катализируемую пепсином, используя в качестве субстрата фрагмент белка, включающий четыре аминокислоты и назовите класс фермента; б) рассчитайте удельную активность фермента, если 5 мг пепсина при оптимальных условиях (рН 1,5 – 2,0 и температуре 37 0С) катализирует образование 500 мкмоль пептидов за 10 мин; в) объясните, как изменится активность пепсина, если при атрофии слизистой оболочки желудка уменьшается выработка соляной кислоты. Тестовые задания по разделу «Ферменты» 1. Какие положения правильно характеризуют активный центр ферментов? 1) это участок, непосредственно взаимодействующий с субстратом и участвующий в катализе; 2) между активным центром и субстратом имеется комплементарность; 3) активный центр составляет относительно небольшую часть молекулы фермента; 4) в активный центр входят только полярные аминокислоты. 2. Объясните биохимический смысл некоторых требований, предъявляемых к хранению и использованию ферментных препаратов. 1. Растворение сухого препарата дистиллированной водой комнатной температуры. 2. При растворении препарата перемешивать осторожно, не допуская образования пены. 3. Хранение раствора препарата при низкой температуре. 4. При необходимости длительного хранения высушивание препарата и запаивание в вакуумные ампулы. 3. При длительном приеме сульфаниламидов или антибиотиков у человека может возникнуть гиповитаминоз В6. Чем это обусловлено? 1) нарушением включения витамина в кофермент; 2) недостатком витамина в пище; 3) нарушением всасывания витамина; 4) подавлением микрофлоры кишечника. 4. Изоферменты – формы фермента, которые: А. Катализируют одну реакцию Б. Различаются по свойствам В. Распределяются в разных тканях неодинаково Г. Являются продуктами экспрессии одного гена Д. Образуются путем объединения разных субъединиц в молекулу активного олигомерного фермента. 5. АТФ: А. Участвует в реакциях катализируемых лигазами Б. Является универсальным аккумулятором энергии В. Синтезируется путем окислительного фосфорилирования Г. Запасается в клетках в значительных количествах Д. В сутки синтезируется в количестве, равном массе тела. 6. Установите соответствие. Витамин Кофермент: 1. Витамин РР А. КоА 2. Пантотеновая кислота Б. NADP 3. Витамин В2 В. FMN Г. Н4-фолат Д. Пиридоксальфосфат. 7. Скорость ферментативной реакции зависит от …
8. Выберите один правильный ответ. Наибольшая активность аланинаминотрансферазы (АЛТ) обнаруживается в клетках: А. Миокарда Б. Печени В. Почек Г. Скелетных мышц Д. Поджелудочной железы. 9. Выберите один правильный ответ. Пептид с N-концевой аминокислотой Тир образуется из указанного под действием фермента: - Ала- Сер- Гли- Тир – Гис – Лиз – Вал – А. Пепсина Б. Трипсина В. Карбоксипептидазы Г. Химотрипсина Д. Аминопептидазы 10. Выберите один правильный ответ. Пептид с С-концевой аминокислотой Арг образуется из указанного под действием фермента: - Цис-Мет-Арг-Гли-Ала-Фен-Вал-Сер- А. Трипсина Б. Химотрипсина В. Эластазы Г. Карбоксипептидазы Д. Пепсина 11. Неодинаковая скорость протекания одного и того же метаболического пути в разных органах может быть обусловлен различиями в определенных свойствах и строении ферментов. Выберите правильный ответ: 1) количество ферментов; 2) активность ферментов; 3) изоферментный состав; 4) ферментный состав. 12. Назовите типы связей субстрата с активным центром фермента: 1) гидрофобные; 2) водородные; 3) ионные; 4) ковалентные. 1 Фермент: а) сукцинатдегидрогеназа; б) малатдегидрогеназа; в) пируваткиназа г) гликогенсинтетаза; д) аминотрансфераза. 3. Установите соответствие: Кофермент:
Раздел 3. Витамины Витамины - это низкомолекулярные органические вещества разнообразного строения. В клетке витамины модифицируются до коферментной формы. В настоящее время известно 13 витаминов, которые подразделяют на два типа: водорастворимые витамины и жирорастворимые витамины. |
