ворлдскилз. Методика определения массовой доли 5водной сернокислой меди (II) в реактиве йодометрическим методом и методом ионообменной хроматографии
 Скачать 50.48 Kb. Скачать 50.48 Kb.
|
|
Методика определения массовой доли 5-водной сернокислой меди (II) в реактиве йодометрическим методом и методом ионообменной хроматографии 1 Область применения Методика распространяется на 5-водную сернокислую медь (II) по ГОСТ 4165-78 и устанавливает процедуру определения массовой доли 5-водной сернокислой меди (II) йодометрическим методом на основе ГОСТ 4165-78 « Реактивы. Медь (II) сернокислая 5-водная» и методом ионообменной хроматографии. Сопоставление результатов анализов, полученных йодометрическим методом и методом ионообменной хроматографии выполняется по ОСТ 95 10460-2001. По физико-химическим показателям 5-водная сернокислая медь (II) должна соответствать требованиям и нормам ГОСТ 4165-78, указанным в таблице 1. Таблица 1 - Физико-химические показатели меди (II) сернокислой 5-водной
2 Сущность метода 2.1 Йодометрический метод основан на реакции восстановления меди (II) до меди (I) йодистым калием в слабокислой среде. Выделившийся йод титруют раствором тиосульфата натрия в присутствии крахмала. 2.2 Метод ионообменной хроматографии основан на реакции обмена ионов анализируемой пробы на подвижные ионы ионита. Обмен ионами между ионитом и анализируемым раствором происходит в эквивалентном соотношении. При пропускании раствора сернокислой меди через катионит в H+ - форме катионы меди (II) обмениваются на ионы водорода, при этом выделяется кислота в количестве, эквивалентном содержанию сернокислой меди в растворе. Выделившуюся кислоту титруют раствором гидрооксида натрия в присутствии метилового оранжевого. Процесс ионного обмена можно выразить следующим уравнением реакции: 2RH + CuSO4 ↔ R2Cu + H2SO4 Процесс титрования выделившейся кислоты гидрооксидом натрия можно выразить следующим уравнением реакции: H2SO4 + 2NaOH → Na2SO4 + 2H2O 3 Средства измерений, вспомогательное оборудование, реактивы, материалы 3.1 Весы электронные аналитические с пределом допускаемой абсолютной погрешности взвешивания не более ± 0,0005 г, с наибольшим пределом взвешивания не менее 210 г по ГОСТ Р 53228-2008. 3.2 Термогигрометр типа ИВТМ-7 М с погрешностью измерения относительной влажности ± 2,0 % в диапазоне измерений от 0 % до 99 %, погрешностью измерения температуры ± 0,2 °С в диапазоне измерений от минус 20 °С до плюс 60 °С. 3.3 Секундомер электронный. 3.4 Бюретки 1-1-2-50-0,1 по ГОСТ 29251-91. 3.5 Пипетки градуированные 2-1-2-2 по ГОСТ 29227-91. 3.6 Пипетки с одной отметкой 2-2-10, 2-2-25 по ГОСТ 29169-91. 3.7 Цилиндры мерные по ГОСТ 1770-74. 3.8 Пробирки мерные П-1-10-0,1 ХС по ГОСТ 1770-74. 3.9 Пробирки П-1-16-150 по ГОСТ 25336-82. 3.10 Колбы конические Кн-1-250-24/29, Кн-2-250-34, Кн-2-500-34 ТХС по ГОСТ 25336-82. 3.11 Стаканы лабораторные стеклянные по ГОСТ 25336-82. 3.12 Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82. 3.13 Воронки лабораторные типа В по ГОСТ 25336-82. 3.14 Палочки стеклянные по ТУ 4320-012-29508133-2008. 3.15 Пипетки Пастера. 3.16 Часы песочные. 3.17 Колонка хроматографическая стеклянная с краном К 1Х-32-2,5 длина 320 мм, внутренний диаметр 24 мм. В качестве колонки возможно использовать делительную воронку ВД-1-100 ХС по ГОСТ 25336. 3.18 Стеклянная вата или стекловолокно. 3.19 Вода дистиллированная по ГОСТ Р 58144. 3.20 Катионит марки КУ-1 или КУ-2-8 по ГОСТ 20298, 1-го сорта. 3.21 Калий йодистый по ГОСТ 4232, раствор с массовой долей 30 %, раствор приготовлен заранее. 3.22 Крахмал растворимый по ГОСТ 10163, раствор с массовой долей 0,5 %, раствор приготовлен заранее. 3.23 Кислота серная по ГОСТ 4204, раствор с массовой долей 20 %, раствор приготовлен заранее. 3.24 Кислота соляная по ГОСТ 3118, расвор с массовой долей 3 %, раствор приготовлен заранее. 3.25 Метиловый оранжевый (индикатор), раствор с массовой долей 0,1 %, готовят по ГОСТ 4919.1, раствор приготовлен заранее. 3.26 Смешанный индикатор (метиловый красный и метиленовый голубой), готовят по ГОСТ 4919.1, раствор приготовлен заранее. 3.27 Спирт этиловый ректификованный технический по ГОСТ 18300. 3.28 Стандарт – титр калий двухромовокислый (бихромат калия) С(1/6 K2Cr2O7)=0,1 моль/дм3 по ТУ 2642-581-00205087-2007, раствор молярной концентрации эквивалента С(1/6 K2Cr2O7)=0,1 моль/дм3, раствор приготовлен заранее. 3.29 Стандарт – титр натрий серноватистокислый (тиосульфат натрия) 5-водный C(Na2S2O3·5H2O)=0,1 моль/дм3 по ТУ 2642-001-33813273-97, раствор молярной концентрации эквивалента C(Na2S2O3·5H2O)=0,1 моль/дм3 , раствор приготовлен заранее. 3.30 Стандарт-титр натрия гидроокись по ТУ 2642-001-33813273-97 или Натрия гидроокись по ГОСТ 4328, раствор молярной концентрации эквивалента С(NaOH)=0,1 моль/дм3 (0,1 н.), раствор приготовлен заранее. 3.31 Стандарт-титр раствора кислоты соляной по ТУ 2642-001-33813273-97, раствор молярной концентрации эквивалента C(HCl) = 0,1 моль/дм3, раствор приготовлен заранее. Примечание - Допускается применять другие средства измерений, аппаратуру, вспомогательные устройства, реактивы с метрологическими и техническими характеристиками не хуже, чем у вышеуказанных в настоящей методике, в т.ч. импортные. 4 Подготовка к измерениям 4.1 Приготовление раствора йодистого калия с массовой долей 30 % (раствор приготовлен заранее) 15,00 г йодистого калия растворяют в 35 см3 свежепрокипяченной воды. Раствор хранят в склянке из темного стекла. Раствор применяют свежеприготовленным. 4.2 Приготовление раствора крахмала растворимого с массовой долей 0,5 % (раствор приготовлен заранее) Навеску крахмала массой 0,5 г размешивают в 10 см3 воды до получения однородной кашицы, смесь медленно вливают при перемешивании в 90 см3 кипящей воды и кипятят в течение 2-3 мин, охлаждают. Раствор применяют свежеприготовленным. 4.3 Приготовление растворов серной кислоты с массовой долей 20 % и соляной кислоты с массовой долей 3 % (растворы приготовлены заранее) Объем концентрированной кислоты Vк-ты, см3, необходимый для приготовления 1 дм3 раствора, рассчитывают по формуле 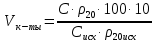 , (1) , (1)где 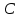 – требуемая массовая доля кислоты в растворе, %; – требуемая массовая доля кислоты в растворе, %;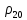 – требуемая плотность раствора кислоты, г/ см3; – требуемая плотность раствора кислоты, г/ см3;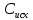 – массовая доля исходной концентрированной кислоты, %; – массовая доля исходной концентрированной кислоты, %;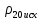 – плотность исходной концентрированной кислоты, г/ см3. – плотность исходной концентрированной кислоты, г/ см3.Зависимость массовой доли кислоты от плотности кислоты приведена в справочниках. 4.4 Приготовление раствора калия двухромовокислого (бихромата калия) молярной концентрации эквивалента С (1/6 K2Cr2O7)=0,1 моль/дм3 (раствор приготовлен заранее) Раствор молярной концентрации эквивалента С(1/6 K2Cr2O7)=0,1 моль/дм3 готовят из стандарт - титра в соответствии с инструкцией по приготовлению титрованных растворов из стандарт-титров. Раствор хранят в склянке из темного стекла. 4.5 Приготовление раствора серноватистокислого натрия (тиосульфата натрия) молярной концентрации эквивалента C(Na2S2O3·5H2O)=0,1 моль/дм3 (раствор приготовлен заранее) Раствор молярной концентрации эквивалента С(Na2S2O3·5H2O)=0,1 моль/дм3 готовят из стандарт - титра в соответствии с инструкцией по приготовлению титрованных растворов из стандарт-титров. Раствор хранят в склянке из темного стекла. 4.6 Определение коэффициента поправки раствора тиосульфата натрия 25,00 см3 раствора двухромовокислого калия помещают в коническую колбу вместимостью 250 см3 с пришлифованной пробкой, прибавляют 75,0 см3 воды, к раствору быстро прибавляют 10,00 см3 раствора йодистого калия, 20,0 см3 раствора серной кислоты, сразу закрывают колбу пробкой, смоченной раствором йодистого калия, перемешивают и выдерживают в темноте (накрывают темным пакетом) не менее 10 мин, после чего пробку и стенки колбы обмывают дистиллированной водой и выделившийся йод титруют из бюретки раствором 5-водного серноватистокислого натрия до перехода окраски раствора в коричнево-зеленую, затем прибавляют 2,00 см3 раствора крахмала и продолжают титрование при тщательном перемешивании до перехода сине-фиолетовой окраски раствора в голубую. Коэффициент поправки раствора тиосульфата натрия вычисляют по формуле
где V – объем раствора тиосульфата натрия, израсходованный на титрование, см3. Коэффициент поправки вычисляют с точностью до четвёртого десятичного знака по каждому объему установочного вещества. За результат принимают среднее арифметическое K результатов трёх параллельных определений K1, K2, K3 с точностью до четвертого десятичного знака, полученных по формуле
Значение коэффициента поправки должно быть равным 1,0000±0,0300. 4.7 Приготовление раствора гидроокиси натрия молярной концентрации эквивалента С(NaOH)=0,1 моль/дм3 (0,1 н.) (раствор приготовлен заранее) Раствор молярной концентрации эквивалента С(NaOH)=0,1 моль/дм3 (0,1 н.) готовят из стандарт - титра в соответствии с инструкцией по приготовлению титрованных растворов из стандарт-титров. При отсутствии стандарт - титра раствор готовят из натрия гидроокиси по ГОСТ 25794.1. 4.8 Приготовление раствора соляной кислоты молярной концентрации эквивалента С(HCl)=0,1 моль/дм3 (0,1 н.) (раствор приготовлен заранее) Раствор молярной концентрации эквивалента С(HCl)=0,1 моль/дм3 (0,1 н.) готовят из стандарт - титра в соответствии с инструкцией по приготовлению титрованных растворов из стандарт-титров. 4.9 Определение коэффициента поправки раствора гидроокиси натрия (30 – 40) см3 раствора соляной кислоты, отмеренных из бюретки, помещают в коническую колбу вместимостью 250 см3, доводят объем раствора до 100 см3 дистиллированной водой, прибавляют 3 - 4 капли раствора смешанного индикатора и титруют из бюретки раствором гидроокиси натрия до перехода красно-фиолетовой окраски раствора в зеленую. Для установления коэффициента поправки используют не менее трёх разных объёмов установочного вещества. Коэффициент поправки вычисляют с точностью до четвёртого десятичного знака по каждому объему установочного вещества. Расхождение между коэффициентами не должно превышать 0,0010. За результат принимают среднее арифметическое КЩ результатов трёх параллельных определений КЩ1, КЩ2, КЩ3 с точностью до четвёртого десятичного знака, полученных по формуле
Значение коэффициента поправки должно быть равным 1,0000±0,0300. 4.10 Подготовка хроматографической колонки (колонка подготовлена заранее) За 8 часов до начала работы катионит замачивают в дистиллированной воде, затем его переносят в хроматографическую колонку. Колонку подготавливают следующим образом: заполняют прежде всего носик колонки водой, в нижнюю часть делительной воронки помещают тонкий слой стекловаты, затем загружают катионит до высоты столба 3,5 – 4 см, сверху также помещают тонкий слой стекловаты. Катионит промывают 1-2 раза дистиллированной водой. Над катионитом должен находиться слой жидкости. После этого переводят катионит в Н+ - форму. Для этого через колонку пропускают 40,0 см3 3 % раствора соляной кислоты, одновременно сливают жидкость через носик колонки. Сливание прекращают, когда уровень кислоты станет на 2 см выше слоя катионита в колонке, закрывают колонку сверху пробкой и оставляют жидкость на 30 минут в колонке. Затем постепенно промывают колонку дистиллированной водой до нейтральной реакции по метиловому оранжевому. 5 Проведение анализа 5.1 Определение массовой доли 5-водной сернокислой меди (II) йодометрическим методом Выполняют не менее трех параллельных определений. Навеску 5-водной сернокислой меди (II) около 1,0000 г количественно переносят в коническую колбу вместимостью 250 см3 60,0 см3 воды. К раствору быстро прибавляют 10,00 см3 раствора йодистого калия, 20,0 см3 раствора серной кислоты, перемешивают и титруют раствором тиосульфата натрия при постоянном перемешивании до бледно-желтой окраски, затем прибавляют пипеткой 2 см3 раствора крахмала и продолжают титрование до исчезновения синей окраски раствора. 5.2 Определение массовой доли 5-водной сернокислой меди (II) методом ионообменной хроматографии Выполняют не менее трех параллельных определений. Навеску 5-водной сернокислой меди (II) около 0,5000 г количественно переносят в стакан 50,0 см3 воды. Перед пропусканием анализируемого раствора хроматографическую колонку, заполненную катионитом промывают дистиллированной водой до нейтральной реакции по метиловому оранжевому. Для этого через колонку пропускают дистиллированную воду со скоростью пропускания 2-3 капли в секунду. Периодически отбирают по 2 см3 раствора, вытекающего из колонки в мерную пробирку, прибавляют 1 каплю индикатора метилового оранжевого. Промывание проводят до получения желтой окраски метилового оранжевого. Над слоем катионита всегда должен находиться слой жидкости около 2 см. При работе в слое катионита должно быть полное отсутствие пузырьков воздуха. Раствор сернокислой меди пропускают порциями по 20 - 25 см3 через колонку, заполненную катионитом, со скоростью 1-2 капли в секунду в коническую колбу вместимостью 500 см3. Поддерживают неизменный объем раствора над слоем катионита, подливая дистиллированную воду порциями по 20 - 25 см3. Промывают катионит дистиллированной водой со скоростью 1-2 капли в секунду. Промывные воды собирают в ту же коническую колбу вместимостью 500 см3. Периодически проверяют полноту промывания катионита, для этого отбирают по 2 см3 раствора, вытекающего из колонки в мерную пробирку, прибавляют 1 каплю индикатора метилового оранжевого. Содержимое пробирки выливают в коническую колбу с уже пропущенным через колонку анализируемым раствором. Промывание продолжают до исчезновения кислой реакции по метиловому оранжевому. Собранные промывные воды титруют из бюретки раствором гидроокиси натрия до перехода розовой окраски раствора в желтовато-оранжевую. Количество катионита пригодно для четырех хроматографических отделений, после этого катионит следует заменить или регенерировать. 6 Обработка результатов измерений 6.1 Среднее арифметическое значение величин ( 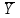 ) рассчитывают по результатам параллельных определений по формуле ) рассчитывают по результатам параллельных определений по формуле
где Yi – результат параллельного определения; n – число параллельных определений. 6.2 Массовую долю 5-водной сернокислой меди (II) йодометрическим методом, XЙМ, %, вычисляют по формуле
где 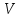 - объем раствора 5-водного серноватистокислого натрия молярной концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3; - объем раствора 5-водного серноватистокислого натрия молярной концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3; 0,02497 - масса 5-водной сернокислой меди (II), соответствующая 1 см3 раствора серноватистокислого натрия молярной концентрации точно 0,1 моль/дм3, г; m – масса навески 5-водной сернокислой меди (II), г. 6.3 Массовую долю 5-водной сернокислой меди (II) методом ионообменной хроматографии, XИХ, %, вычисляют по формуле
где 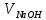 - объем раствора гидроокиси натрия молярной концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3; - объем раствора гидроокиси натрия молярной концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3; 0,012485 - масса 5-водной сернокислой меди (II), соответствующая 1 см3 раствора гидроокиси натрия молярной концентрации точно 0,1 моль/дм3, г. 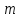 - масса навески 5-водной сернокислой меди (II), г; - масса навески 5-водной сернокислой меди (II), г; 6.4 За результат измерений принимают среднее арифметическое результатов трех параллельных определений, абсолютное расхождение между наибольшим (Xmax) и наименьшим (Хmin) значениями которых не должно превышать допускаемое расхождение, равное 0,40 м.д. %. Допускаемая абсолютная суммарная погрешность результата анализа ± 0,6 м.д. % при доверительной вероятности 6.5 Оформление результатов измерений Результат измерений представляют в виде ( где ± Δ - абсолютное значение погрешности измерения массовой доли 5-водной сернокислой меди (II), м.д. %. 6.6 Сопоставление результатов анализов, полученных йодометрическим методом и методом ионообменной хроматографии Расхождение результатов, полученных йодометрическим методом и методом ионообменной хроматографии признаются незначимыми, при выполнении следующего условия │ 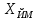 - - 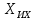 │ ≤ │ ≤ 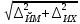 , (9) , (9)где 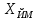 и и 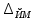 - соответствующие значения результата измерений массовой доли 5-водной сернокислой меди (II), и его абсолютной погрешности, полученных йодометрическим методом, м.д. %; - соответствующие значения результата измерений массовой доли 5-водной сернокислой меди (II), и его абсолютной погрешности, полученных йодометрическим методом, м.д. %;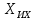 и и 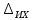 - соответствующие значения результата измерений массовой доли 5-водной сернокислой меди (II) и его абсолютной погрешности, полученных методом инообменной хроматографии, м.д. %. - соответствующие значения результата измерений массовой доли 5-водной сернокислой меди (II) и его абсолютной погрешности, полученных методом инообменной хроматографии, м.д. %. | ||||||||||||||||||||

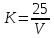
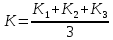
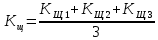
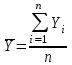
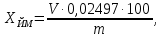
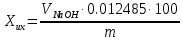 ,
,