дз по методы контроля и анализ вещества. Министерство науки и высшего образования рф старооскольский технологический институт им. А. А. Угарова
 Скачать 71.39 Kb. Скачать 71.39 Kb.
|
|
Министерство науки и высшего образования РФ Старооскольский технологический институт им. А.А. Угарова (филиал) федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский технологический университет «МИСиС»
Домашнее задание
Старый Оскол 2021 Задача №1 Вычислить массовую долю (%, масс.) свинца в бронзе, если из навески образца массой 1,000 г получили 0,0430 г PbSO4 и аналитический множитель(фактор пересчета) для этого определения. Решение: Расчёт процентного содержания определяемого вещества в пробе проводим по формуле: 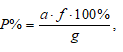 Ar(Pb)= 207,2; Mr(PbSO4) = 303,266; f = Ar(Pb)/Mr(PbSO4) = 207,2/303,266 = 0,6832. P%= 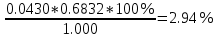 Ответ: Р = 2,94% Задача 2 Рассчитать массовую долю меди (%) в руде по следующим данным: из навески руды массой 0,5100 г медь после ряда операций была переведена в раствор в виде Cu2+; при добавлении к этому раствору иодида калия выделился иод, на титрование которого пошло 14,10 мл тиосульфата натрия, имеющего титр по меди Т(Na2S2O3/Cu) = 0,0065 г/мл. Решение: Сущность иодометрического определения меди описывается следующими реакциями: 2Cu2+ + 4I- = I2 + 2CuI↓ I2 + 2S2O32- = 2I- + S4O62- При титровании по методу замещения n(Cu) = n(1/2 I2) = n(Na2S2O3). Расчетная формула имеет вид: mCu = 0.0065*14.10=0.09165, где M(Na2S2O3) и M(Cu) – молярные массы эквивалента тиосульфата натрия и меди соответственно. ωCu= 0.09165/0.5100*100%= 17.97% Ответ: 17.97% Задача 3 По результатам фотометрического анализа железа для стандартных растворов были получены следующие данные отсчетов по шкале гальванометра .
Построить калибровочные графики в системах координат -С и D-C. Вывести уравнение для второго графика и определить содержание железа по графикам и расчетным путем, если отcчет по шкале гальванометра равен 1= 73,5. Для решения задачи необходимо рассчитать логарифмы отклонений lgi и оптические плотности Di=lg 100-lgi. Построить калибровочные графики зависимостей. Для определения уравнения зависимости D=f(C) вида D=kC, коэффициент k=tga, где а-угол наклона прямой к оси абсцисс. Решение: Составим таблицу данных:
Построим графики зависимостей: По полученным данным строим графики в координатах ∆ —Си D —С  График зависимости ∆ = f(C) 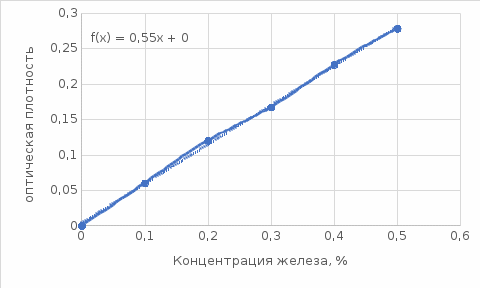 График зависимости D= f(C) По графику зависимости  f (C) определим значение концентрации при f (C) определим значение концентрации при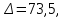 которая составит 0,29% которая составит 0,29%Уравнение зависимости D=f (C) имеет вид D=0.5537*C, следовательно С=1,806D. Рассчитаем значения концентрации  по найденному уравнению и найдем отклонение от измеренных значений по найденному уравнению и найдем отклонение от измеренных значений 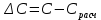 . И сведем расчеты в таблицу . И сведем расчеты в таблицу  =1,806*0,06=0,108 =1,806*0,06=0,108 =1,806*0,12=0,216 =1,806*0,12=0,216 =1,806*0,167=0,307 =1,806*0,167=0,307 =1,806*0,227=0,415 =1,806*0,227=0,415 =1,806*0,278=0,502 =1,806*0,278=0,502
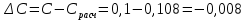 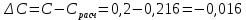  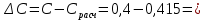 -0,015 -0,015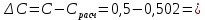 -0,002 -0,002
Вычислим D при отклонении   Для найденного значения по графику определяем концентрацию железа 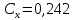 По найденному уравнению значение концентрации составит: 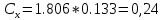 Погрешность определения составит: 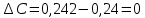 ,002 ,002Задача 4. На основании данных, приведенных в таблице определить содержание заданного элемента в исследуемом объекте, используя метод калибровочного графика в фотометрическом анализе. Калибровочный график построить в координатах оптическая плотность-объем стандартного раствора. Определив по калибровочному графику значение объема стандартного раствора, пересчитать на концентрацию (1 мкг=10-6 г). При построении калибровочного графика на миллиметровой бумаге необходимо правильно выбрать масштаб с тем. Чтобы точность вычислений соответствовала точности исходных данных и требуемой точности результата измерений.
Исследуемый раствор и его концентрация Fe(%,масс.) в титановой руде при навеске 0.3455г в 500 мл рас-твора. Решние: 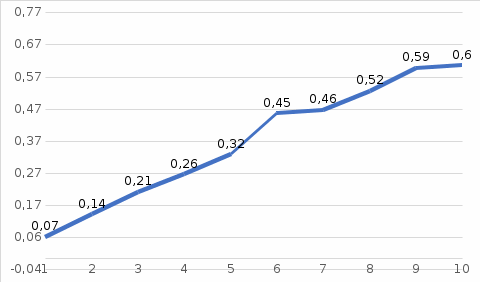 Из графика следует, что  Рассчитаем концентрацию исследуемого раствора 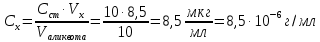 Рассчитаем массу и массовую долю Fe 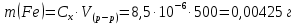 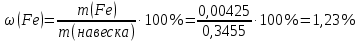 Ответ: 1,23%
Sb(%, масс.) в феррохроме при навеске m, г (для фотометри-рования используется экстрагирование сурьмы из всего приготов-ленного раствора) 5.503  Из графика следует, что  Рассчитаем концентрацию исследуемого раствора 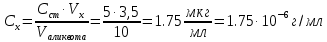 Рассчитаем массу и массовую долю Sb  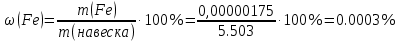 Задача 5.1. Навеску сплава массой m=0,57 г растворили и через полученный раствор в течении =25 мин. пропускали ток силой I(A)=0,30, в результате чего на катоде выделилась медь. Определить массовую долю (%, масс.) меди в сплаве, если выход по току составлял =75%. Решение: На катоде 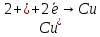 . Рассчитаем массу Cu. . Рассчитаем массу Cu.По закону Фарадея 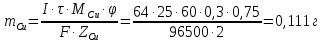 M-молярная масса; F-число Фарадея Z-число электронов в полуреакции на катоде. Рассчитаем массовую долю Cu в сплаве 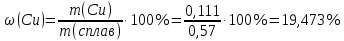 Ответ: 19,473% Задача 5.2. Какое время необходимо для полного выделения кадмия из V=0,010 л раствора с концентрацией с(1/2 CdSO4)=0,25 моль/л, если сила тока равна I(A)=0,35. Выход по току равен =75%. Решение: 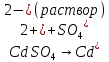 Катод (-)  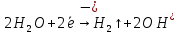 Анод (+) 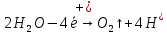 Рассчитаем массу Cd 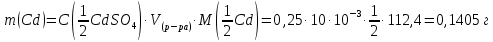 По закону Фарадея  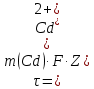 Ответ: 15 мин Задача 6 Раствор дихромата калия объемом 20,00 мл оттитровали ионами железа (II), генерируемыми при силе тока 0,350 А в течение 20 мин; конец реакции фиксировался потенциометрический. Определить молярную концентрацию раствора K2Cr2O7 (  экв.= экв.=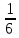 ) )Решение:   При прохождении 96500 Кл восстанавливается 1 моль при 420 кл : 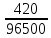 =0,0043 экв. =0,0043 экв.  . В 20 мин находиться 0,0043 моль экв. Дихромата калия. . В 20 мин находиться 0,0043 моль экв. Дихромата калия.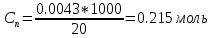  Ответ:0,0358 Задача 7 Определить массовую долю меди в алюминии. Серебра в медных отливках, сурьмы в свинце, марганца в стальных деталях по значениям почернений аналитической пары элементов. Данные для эталонных образцов приведены в таблице ниже.
Характеристики эталонных образцов
Решение: Запишем уравнение Ломакина для данной системы 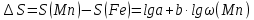 Построим график зависимости S от lg(Mn), по которому определим неизвестную концентрацию марганца в стали. Составим таблицу данных.
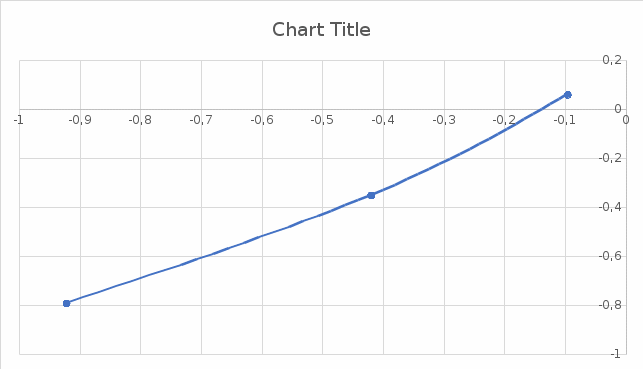 Из графика следует, что 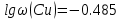 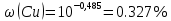 Ответ: 0,327% ДОМАШНЕЕ ЗАДАНИЕ № 2 Вариант № 11 1 Качественное определение компонентов смеси хроматографическим методом. Адсорбционная хроматография – старейший хроматографический метод – основан на различии в равновесном распределении компонентов смеси между сорбентом и подвижной фазой. Это распределение зависит от характера и прочности адсорбции каждого компонента, которые, в свою очередь, определяются природой адсорбента, адсорбируемого вещества и подвижной фазы. 2 Какие объекты можно анализировать с помощью фотоэлектроколориметра? Фотоэлектроколориметр является оптическим прибором, который призван совершать точные замеры концентрации различных веществ в растворах. Принцип работы установки базируется на способности окрашенных жидкостей поглощать проходящий через них световой луч. 3 Получение рентгеновских спектров в РФА. РФА – это метод анализа, который используется на протяжении многих лет для определения элементного состава широкого спектра материалов. 4 Электрогравиметрия, условия проведения и возможности. Электрогравиметрия- селективный метод: при равенстве исходных концентраций компонентов раздельное выделение на электроде возможно при разности их электродных потенциалов порядка 0,3 В (для однозарядных ионов) или 0,1 В (для двухзарядных ионов). 5 Атомный эмиссионный спектральный анализ. Способы регистрации спектров. Атомно-эмиссионный спектральный анализ (АЭС) основан на термическом возбуждении атомов или ионов, которые находятся в паро- или газообразном состоянии, и регистрации оптических спектров (качественный анализ) или измерении интенсивности отдельных спектральных линий определяемых элементов (количественный анализ). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 C
C