Контрольная работа по Химии 91 вариант 1 семестр ТулГУ. КР№1_Волкова Е.А.. Минобрнауки россии федеральное государственное бюджетное образовательное учреждение высшего образования Тульский государственный университет
 Скачать 68.16 Kb. Скачать 68.16 Kb.
|
|
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Тульский государственный университет» Интернет-институт КОНТРОЛЬНО РАБОТА № 1 по дисциплине «Химия» Семестр 1 Вариант 91 Выполнил: студент гр. ИБ360821 Волкова Евгения Александровна Проверил: Дмитриева Елена Дмитриевна Тула 2022 Задание 1. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) хлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите для этих веществ количество вещества эквивалентов и молярные массы эквивалентов, если массы веществ 18, 43 г. Решение: а) Ca(HCO3)2+2HCl=CaCl2+2CO2↑+2H2O Фактор эквивалентности fэ(Ca(HCO3)2) = 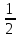 Э(Ca(HCO3)2)=0,5 моль Молярная масса Ca(HCO3)2=162 г/моль Mэ(Ca(HCO3)2)=fэ(Ca(HCO3)⋅M(Ca(HCO3)2)=162/2=81 г/моль Количество вещества эквивалента равно 18,43/81 = 0,23 моль. б) AlOHCl2+HCl=AlCl3+H2O Фактор эквивалентностиfэ(AlOHCl2) = 1 Э(AlOHCl2) = 1 моль Молярная масса AlOHCl2 = 115 г/моль Mэ(AlOHCl2) = fэ(AlOHCl2)⋅M(AlOHCl2)=115 г/моль Количество вещества эквивалента равно 18,43/115=0,16 моль. Задание 2. Какова нормальность раствора NaOH, если на нейтрализацию 150 мл этого раствора пошло 80 г 5% раствора серной кислоты? Решение: 2NaOH + H2SO4 = Na2SO4 + 2H2O Массовая концентрация раствора: 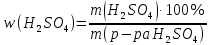 Находим массу серной кислоты в растворе: 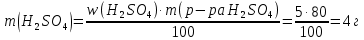 Молярные массы гидроксида натрия и серной кислоты: М(NaOH)=40 г/моль M(H2SO4)=98 г/моль n(H2SO4) = m/M = 4/98 = 0,04 моля значит n(NaOH) = 0,08 моля Нормальность раствора NaOH: Cн(NaOH) = n/V Cн(NaOH) = 0,08 / (1·0,15) = 0,53 Н Задание 3. Какие значения могут принимать квантовые числа n, l, ml и m1, характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния? Решение: Главное квантовое число (n) может принимать значения: 1, 2, 3, 4. Орбитальное квантовое число (l) может принимать значения: 0, 1, 2, 3. Максимальное число определяется по формуле l=n-1. Магнитное квантовое число (ml) принимает целочисленные значения от -l до +l, общее количество значений определяется по формуле 2l+1.  Спиновое квантовое число (ms) принимает значения ±1/2. Спиновое квантовое число (ms) принимает значения ±1/2.  12Mg 12Mg 3s Атом магния имеет два внешних электрона, которые имеют следующие квантовые числа: 1) n = 3, l = 0, ml = 0, ms = +1/2; 2) n = 3, l = 0, ml = 0, ms = - 1/2. Задание 4. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Решение: Высшую степень окисления элемента определяет номер группы периодической системы Д.М. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6).
Задание 5. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами? Решение:          В=1 В=1 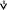  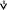  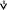  17Cl 17Cl 3s 3p 3d   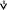              B=3 B=317Cl** 3s 3p 3d   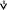              B=5 B=517Cl** 3s 3p 3d B=7                 17Cl*** 17Cl*** 3s 3p 3d Задание 6. Определите среднюю энергию связи Р–Н в молекуле РH3, если 1/2Р2(г)+3/2Н2(г)=РН3(г)+17,17 кДж, а энергия диссоциации Р2 и Н2 соответственно равны 489,1 кДж/моль и 435,9 кДж/моль. Решение: 1/2Р2(г)+3/2Н2(г)=РН3(г); ΔfНºРН3= - 17,17 кДж 1/2Р2(г)=Р; ΔНºдиссР2=489,1 кДж/моль 1/2Н2(г)=Н; ΔНºдиссН2=435,9 кДж/моль Рассчитаем ΔНº реакции образования Р+3Н= РН3 ΔfНºРН3 - ΔНºдиссР2 - 3·ΔНºдиссН2 = - 17,17 - 489,1 - 3·435,9 = - 1813,97 кДж/моль т.е. теплота образования РН3 из атомов составляет -1813,97 кДж/моль. Среднее значение энергии связи Р – Н составит – 1813,97/3= - 604,66 кДж/моль. Отсюда энергия связи: ЕсвР-Н= - ΔНºР-Н = 604,66 кДж/моль. Ответ: 604,66 кДж/моль. Задание 7. Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO, исходя из следующих термохимических уравнений: 4NH3 + 5O2(г) = 4NO(г) + 6Н2О(ж); ΔН1 = -1168,80 кДж; 4NH3 + 3O2(г) = 2N2(г) + 6Н2О(ж); ΔH2 = -1530,28 кДж. Решение: а) Теплота образования - тепловой эффект реакции образования 1 моля данного вещества из простых веществ в стандартном состоянии: 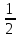 ·N2(г)+ ·N2(г)+ 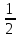 ·O2(г)=NO(г) ·O2(г)=NO(г)б) 4NH3(г)+5O2(г)=4NO(г)+6H2O(ж); ΔHх.р.1=−1168.80 кДж 4NH3(г)+3O2(г)=2N2(г)+6H2O(ж); ΔHх.р.2=−1530.28 кДж Из первой реакции вычтем вторую, получим: 2О2+2N2=4NO(г) В соответствии с законом Гесса ΔН3=ΔН1-ΔН2: 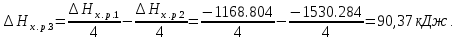 Ответ: 90,37 кДж. Задание 8. Тепловой эффект реакции C + 2N2O = CO2 + 2N2 равен –560,0 кДж. Вычислите стандартную теплоту образования N2O. Решение: Согласно следствию из закона Гесса, тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции. ΔНº = 2·ΔНº298(N2(г)) + ΔНº298(СО2(г)) - ΔНº298(С(тв)) - 2·ΔНº298(N2O(г)) = -560 кДж Теплоты образования простых веществ равны нулю, а стандартная теплота образования ΔНº298(СО2(г)) = -393,513 кДж/моль. Тогда: ΔНº298(N2O(г)) = (ΔНº298(СО2(г)) +560)/2 = (-393,513+560)/2= 83,2535 кДж/моль. Ответ: 83,2535 кДж/моль. Задание 9. Газофазная реакция SO2+1/2O2 ↔ SO3, являющаяся стадией получения серной кислоты, описывается кинетическим уравнением r=k[SO2][O2]. Как изменится скорость этой реакции, протекающей при соотношении реагентов [SO2]:[O2]=2:1, если: а) увеличить избыток SО2 по отношению к О2; б) увеличить избыток О2 по отношению к стехиометрическому количеству О2? Решение: Частные порядки по реагентам SO2 и O2 одинаковы и равны 1. Можем предположить, что увеличение концентрации любого из реагентов одинаковым образом будет влиять на скорость реакции. а) при увеличении избытка SO2 по отношению к O2 в Х раз скорость реакции будет равна: V=k·(Х·[SO2])·[O2]=k·Х·[SO2]·[O2]=Х·r Таким образом при увеличении избытка SO2 по отношению к O2 в Х раз скорость увеличится в Х раза. б) при увеличении избытка O2 по отношению к стехиометрическому количеству O2 в Х раз скорость реакции станет равна: V=k·[SO2]·[Х·O2]=k·Х·[SO2]·[O2] = Х·r Таким образом при увеличении избытка O2 по отношению к стехиометрическому количеству O2 в Х раз скорость реакции увеличится в Х раз. Задание 10. Реакция протекает по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NО] = 0,005 моль/л. Решение: При убыли из системы по 1 моль каждого из исходных веществ образуется 2 моль продукта реакции. В момент времени, когда концентрация NO станет равна 0,005 моль/л, концентрации азота и кислорода будут иметь следующие значения: [N2]` = [N2] - [NO]/2 = 0,049 − 0,005/2=0,0465 моль/л [O2]` = [O2]- [NO]/2 = 0,01 – 0,005/2=0,0075 моль/л Ответ: при [NО] = 0,005 [N2]` = 0,0465 моль/л, [O2]` = 0,0075 моль/л. | ||||||||||||||||||||||
