Ректификация. Ректификация._Мухин_В._С._ХЕБО-14-17. мирэа Российский технологический университет рту мирэа
 Скачать 157.04 Kb. Скачать 157.04 Kb.
|

Отчёт по домашней работе «Ректификация» Вариант 17 Выполнил студент: Мухин Вадим Группа: ХЕБО-14-17 Преподаватель: Таран Ю.А. Москва 2020 Задание. В ректификационную колонну непрерывного действия поступает L1= 2,0 кг/с бинарной смеси метанол-этанол с концентрацией а1= 0,33 кг/кг. Концентрация метилового спирта в дистилляте должна составить а2= 0,76 кг/кг, а в кубовом остатке а0= 0,03 кг/кг. Коэффициент избытка флегмы σ= 1,2. Данные греющего пара Pгр = 3,3 атм. Коэффициент полезного действия тарелки η= 0,7 Определить: число действительных и теоретических тарелок диаметр колонны расходы тепла и греющего пара в кубе, охлаждающей воды в конденсаторе Дано: L1= 2,0 кг/с а1(F)= 0,33 кг/кг а2(D)= 0,76 кг/кг а0(W)= 0,03 кг/кг. σ= 1,2 Pгр = 3,3 атм = 3,34*105 Па η= 0,7 tв / =18ºC tв // =40ºC Kk = 750 Вт / (м2*К) Кконд = 600 Вт / (м2*К) 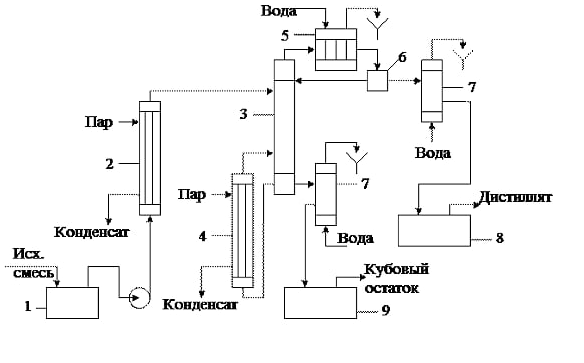 Установка: Установка:1 -Емкость для исходной смеси 2- подогреватель 3- колонна 4- кипятильник 5-дефлегматор 6-делитель флегмы 7-холодильник 8-сборник дистиллята 9-сборник кубового остатка Схема ректификационной установки непрерывного действия Перевод массовых концентраций в мольные 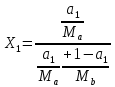 , где Ма =32 кг/кмоль и Мb 46 = кг/кмоль молекулярные массы метанола и этанола соответственно. , где Ма =32 кг/кмоль и Мb 46 = кг/кмоль молекулярные массы метанола и этанола соответственно.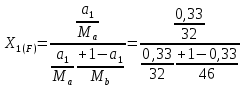 =0,0103125/ (0,0103125+0,014565) = 0,415 =0,0103125/ (0,0103125+0,014565) = 0,415 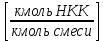 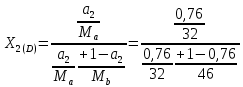 = 0,02375/ (0,02375+0,005217) = 0,82 = 0,02375/ (0,02375+0,005217) = 0,82  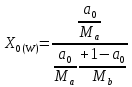 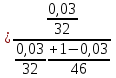 = 0,0009375/ (0,0009375+0,021087) = 0,0009375/ (0,0009375+0,021087)= 0,0426 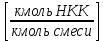 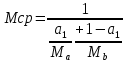 = = 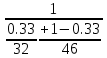 =1/ (0,0103125+0,014565)= 40,2 =1/ (0,0103125+0,014565)= 40,2 Построение диаграммы t,x,y и x,y (по данным фазового равновесия системы метанол-этано при Р= 760 мм.рт.ст. [1]
Таблица №1 Экспериментальные данные парожидкостного равновесия системы ацетон вода при 760 мм.рт.ст 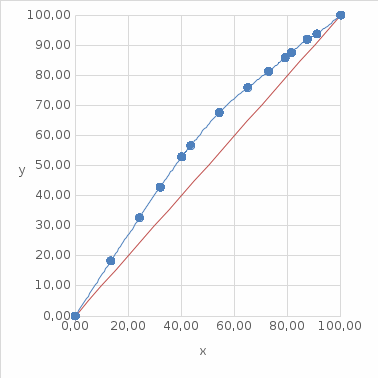 Рис. 1 Фазовая диаграмма х-у системы ацетон вода при 760 мм.рт.ст 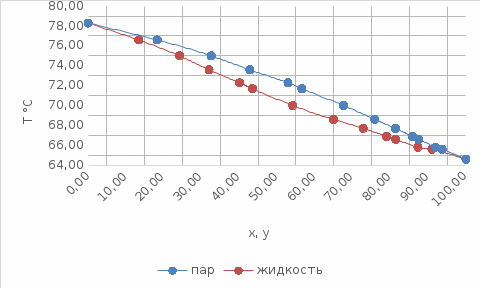 Рис. 2 Диаграмма Т-х-у системы метанол-этанол при 760 мм рт ст. 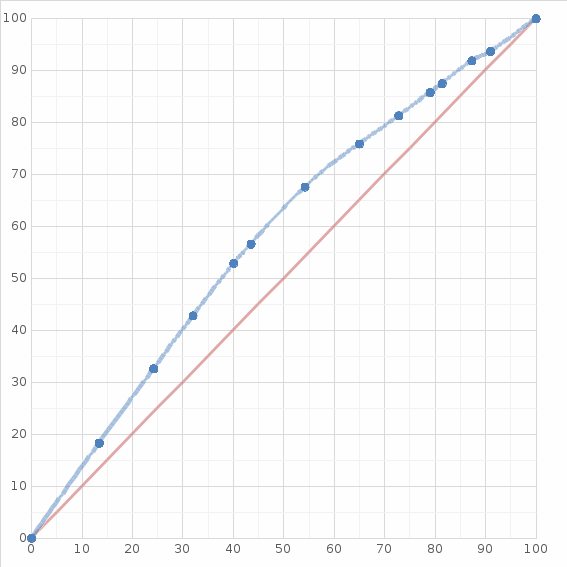 Рис 3. Определение теоретических тарелок 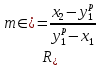 = =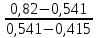 =2.2 =2.2R = 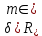 = 1, 2*2.2= 2.64 = 1, 2*2.2= 2.64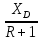 = = 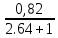 = 0,225 = 0,225nyт = 7 n0т= 25 Количество тарелок нашли по графику (рис 3) Всего тарелок n = nyт + n0т = 7+25= 32 n0m = n0m / η = 7 / 0, 7 = 10 nуm = nуm / η = 25 / 0, 7 = 36 Высота тарельчатой части колонны Нтар = (n – 1) h = (32-1) * 0,4 = 12.4 Где h – расстояние между тарелками, принято h = 0,2 – 0,8 м, интервал значений h = 0,4м 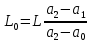 = = 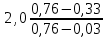 =2,0*(0,43/0,73)= 1, 178 [кг/с] – расход кубового остатка =2,0*(0,43/0,73)= 1, 178 [кг/с] – расход кубового остатка 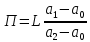 = = 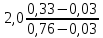 =2,0*(0,3/0,4) = 0,82 [кг/с] – расход продукта =2,0*(0,3/0,4) = 0,82 [кг/с] – расход продукта L1=L0 + П = 1, 178 + 0,82= 2 [кг/с] Расчет диаметра колонны Диаметр колонны dк будем рассчитывать по объемному расходу пара V и выбранной расчетной скорости пара в колонне w 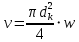 [м3/с] [м3/с] Сначала находим массовый расход пара в верхнем сечении D = (R + 1) П = 0,82 * (2,64+1) = 2,98 [кг/с] Объемный расход V = D/ρп = 2,98 / 3,95 = 0,754 м3 / с Где ρп – плотность пара кг/м3; находим из уравнения Клапейрона – Менделеева: ρ= m/v *RT = ρп RT Отсюда плотность пара: ρп = ρ/(RT) ρ = 1 бар = 105 Па М2 =R*Ma / a2 = 2,64 * 32 / 0,76 = 111,2– средняя молярная масса дистиллята Газовая постоянная для пара в верху колонны: R = 8314 / М2 = 8314/ 111,2 = 74,77 Дж / (кг*°С) T = 273 + 65,6 = 338,3[K] ρп= 105/(R*Т) = 105/(74,77*338,3) = 3,95 [кг/ м3] Рекомендуемая расчетная скорость пара в колонне находится по формуле: 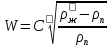 Где С – коэффициент, зависящий от конструкции тарелок и расстояния между тарелками. При выбранном нами ранее расстоянии между тарелками h= 0,4 м и считая, что в колонне тарелки с круглым колпачками, находим по графику [1, рис 6,3 стр 331] значение С = 0,045 Плотность жидкости в верхнем сечении колонн найдем с учетом массовой концентрации а1 по формуле: 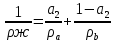 , ,  [кг/ м3] [кг/ м3]  [кг/ м3] [кг/ м3]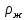 =1/[ (а2/ =1/[ (а2/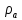 ) + (а2/ ) + (а2/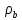 )] = 1/[ (0,76/792) + ( 0,24/ 789)] = 1/(0,001249+/,155*10-5) = 791[кг/ м3] )] = 1/[ (0,76/792) + ( 0,24/ 789)] = 1/(0,001249+/,155*10-5) = 791[кг/ м3]Скорость пара в колонне: 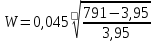 =0,635 [м/с] =0,635 [м/с]Диаметр колонны 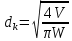 = = 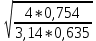 = 1,23 м = 1230 мм = 1,23 м = 1230 мм 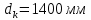 нашли по каталогу [4] нашли по каталогу [4]Определение тепловых нагрузок кипятильника конденсатора расходов греющего пара Dгр и охлаждающей воды Gохл. Расход тепла в кубе и конденсаторе Qk= L0*C0*t0 –L1*C1*t1 +П*(R+1)*(Cb*tb+rb) – П*R*Cb*tb Qk0 = D*r0 = П *(R + 1) rb Теплоемкость определяем по справочнику [2] Са(метанол) = 1,395 [кДж / (кг*гр)] Сb(этанол) = 2,390 [кДж / (кг*гр)] Скрытая теплота парообразования r(метанол) = 1100 [кДж / кг] r(этанол) = 840[кДж / кг] t0 (по графику) =78,1 °C C1 = 2,201 (по аддитивности) – кубовая смесь t1 (по графику) = 72,2°С C2 = 1,634 (по аддитивности) - дистиллят t2 (по графику) = 66,8 °С C0 = 2,360 (по аддитивности) – кубовая жидкость rb(2) = 1037,6 кДж/кг Формула аддитивности 𝑐𝑜=𝑐𝑎𝑎𝑜+𝑐в(1−ао) 𝑐1=𝑐𝑎𝑎1+𝑐в(1−а1) = 1,395*0,33+2,390 * (1−0,33) = 0,460 + 1,601 = 2,201 [кДж / (кг*гр)] 𝑐2=𝑐𝑎𝑎2+𝑐в(1−а2) = 1,395*0,76+2,390 * (1−0,76) = 1,0602 + 0,5736= 1,634 [кДж / (кг*гр)] 𝑐0=𝑐𝑎𝑎0+𝑐в(1−а0) = 1,395*0,03+2,390 * (1−0,03) = 0,04185 + 2,3183 = 2,360 [кДж / (кг*гр)] 𝑟2=𝑟𝑎𝑎2+𝑟в(1−а2) = 1100*0,76 + 840 * (1 – 0,76) = 836 + 201,6 = 1037,6 кДж/кг Qk= L0*C0*t0 – L1*C1*t1 +П*(R+1)*(Cb*tb+rb) – П*R*Cb*tb = = 1,178 * 2,360 *78,1– 2 * 2,201*72,2+ 0,82 *(2,64 + 1) (2,390*66,8+ 1037,66) – 0,82 * 2,64 * 2,390 *66,8 = 3127 кВт Qk0 = D*r0 = П *(R + 1) rb= 0,82 * (2,64 + 1)*1037,6 = 3097 кВт Расчет греющего пара Gа = Qk / rа = 3127000 / 2150000 = 1,45 кг/с Gб = Qk0 / [Cб (t”в– t’в)] = 3097*103/ [2,390*103(40-18)] = 58,9 кг/с Расчет поверхности теплообмена кипятильника и конденсатора F = Q/ (K * ∆t) [м2] Для кипятильника при заданном коэффициенте теплопередачи и движущей силы переноса теплоотдачи ∆tкип = Тп – t0 = 137 – 78,1 = 58,9 °C F = 600 * 103 / (750* 58,9) = 13,58 м2 Аналогичный расчет поверхности теплообмена конденсатора. Здесь средняя движущая сила процесса теплопередачи определяется как средняя логарифмическая. ∆tконд = 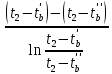 = = 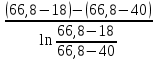 = 22 / 0,599 = 36,73 °C = 22 / 0,599 = 36,73 °CFконд = 3097 * 103 / 600 * 36,73 = 140,53 м2 Список литературы: Равновесие между жидкостью и паром. Справочное пособие, книга первая/ В.Б. Коган, В.М. Фридман, В.В. Кафаров. –М.: Наука, 1966. 645 с. [1] Примеры и задачи по курсу процессов и аппаратов химической технологии / П.Г. Романков,К.Ф. Павлов, А.А.Носков. –10-е изд., перераб. и доп. –Л.: Химия, 1987. 576 с.[2] Процессы и аппараты химической технологии. Общий курс. Учебник для вузов. В 2 книгах / В.Г. Айнштейн, М.К. Захаров, Г.А. Носов и др.; Под ред. проф. В.Г. Айнштейна. СПб. Изд. «Лань», 2018, 1792 с.[3] Колонные аппараты: Каталог 2-е изд. М.: ЦИНТИхимнефтемаш, 1978. 31 с. [4] |
