переделанный реферат1. Митохондриальный метаболизм активных ворм кислорода в свете сердечнососудистой системы и компонентов крови
 Скачать 44.87 Kb. Скачать 44.87 Kb.
|
|
Кафедра клинической биохимии и лабораторной диагностики Реферат на тему: «Митохондриальный метаболизм активных ворм кислорода в свете сердечно-сосудистой системы и компонентов крови» Девиз: «Хороший врач-всегда исследователь, если не в лаборатории, то у постели больного» В. А. Манассеин Санкт-Петербург 2019 ОглавлениеВведение 3 Продукция АФК в митохондриях 4 Деятельность митохондрий и производство активных форм кислорода 4 Роль нейтрофилов в продукции активных форм кислорода 5 Роль антиоксидантной системы 6 Работа антиокскидантной системы при гиперкликемии на примере сердца 7 Работа антиоксидантной системы при атеросклерозе 8 Регуляция образования АФК 9 Проокидантное действие p66shc 9 Антиоксидантное действие белка Klotho 11 Участие в клеточной сигнализации 12 Заключение 14 Список литературы 15 ВведениеМитохондрии являются органоидами эукариотической клетки, обладающими достаточно эффективным способом получения колоссального количества энергии через использование окислительного фосфорилирования. Для достижения столь высокой эффективности митохондрии заставляют питательные вещества высвобождать энергию по шагам с помощью длинной цепи редокс-переносчиков для поэтапного транспорта восстанавливающих эквивалентов (электронов) на кислород. Однако при всём этом могут образовываться повреждающие клетки продукты, именуемые как активные формы кислорода. Как можно наблюдать, за производство гигантского количества энергии приходиться платить. Однако для данной проблемы нашлось решение в виде антиоксидантной системы, обезвреживающей активные формы кислорода. В то же время низкие концентрации АФК образуются практически во всех клетках организма и выполняют сигнальные функции в качестве вторичных посредников в редокс-чувствительных сигнальных путях. Эндотелий сосудов играет роль производителя и мишени для АФ. В норме высокие концентрации АФК характерны для такого явления как респираторный взрыв при фагоцитозе. Оксидативный стресс повышает проницаемость гистогематических барьеров. Нарушение проницаемости эндотелия может быть связано с воздействием активных форм кислорода на ключевые ферменты метаболизма и различные звенья сигнальных и эффекторных путей. Оксидативный стресс играет важную роль в патогенезе широкого спектра сердечно-сосудистых заболеваний: кардиомиопатия, атеросклероз ИБС, клапанных поражений и т.д. Учитывая, высокую смертность, как раз, именно от заболеваний сердечно-сосудистой системы анализ отечественных и зарубежных научных статей может дать информацию о современных походах к изучению данной проблемы, пролить свет на вопросы, ответы на которые были ранее недоступны в силу определённых причин. Продукция АФК в митохондрияхРеакции, генерирующие и метаболизирующие АФК, переплетенные с основными процессами катаболизма, формируют сложную систему процессов, которая характеризуется многообразием и непредсказуемостью. Базовый инициирующий шаг в продукции АФК - одноэлектронное восстановление кислорода – может являться реакцией подчиняющейся закону действующих масс. Такой подход даёт ответ на вопрос соотношения продукции АФК в зависимости от скорости дыхания. Согласно закону действующих масс, скорость реакции определяется концентрацией реагирующего вещества, то есть обозначенные выше процессы достаточно независимы. Исходя из рассматриваемой темы, логичным будет осветить вопросы продукции АФК как причину гибели клеток, ведущую роль в которой отводиться ионам кальция, а также затронуть особенности жизнедеятельность клеток крови при опухолевых состояниях и их взаимоотношения с иммунной системой. Деятельность митохондрий и производство активных форм кислородаИоны кальция стимулируют 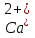 -зависимые дегидрогеназы, что повышает активность цепи дыхания митохондрии и, как следствие, продукцию АТФ посредством окислительного фосфорилирования. Мембранный потенциал митохондрии при стимуляции ионам кальция не изменяется, но в случае накопления митохондриального кальция проницаемость мембраны резко возрастает ,что приводит к рассеиванию потенциала митохондриальной мембраны, остановке митохондриального дыхания и инициации сигнальных путей гибели клеток. Между митохондриями и ЭПС существует связь, обеспечивающая передачу ионов кальция, то есть при увеличении цитозольного содержания -зависимые дегидрогеназы, что повышает активность цепи дыхания митохондрии и, как следствие, продукцию АТФ посредством окислительного фосфорилирования. Мембранный потенциал митохондрии при стимуляции ионам кальция не изменяется, но в случае накопления митохондриального кальция проницаемость мембраны резко возрастает ,что приводит к рассеиванию потенциала митохондриальной мембраны, остановке митохондриального дыхания и инициации сигнальных путей гибели клеток. Между митохондриями и ЭПС существует связь, обеспечивающая передачу ионов кальция, то есть при увеличении цитозольного содержания 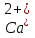 из-за истощения эндоплазматическго ретикулума или какого-то внешнего поступления митохондрии бысто поглощают его через из-за истощения эндоплазматическго ретикулума или какого-то внешнего поступления митохондрии бысто поглощают его через 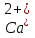 -зависимые неспецифические миохондриальные поры( mPTP). В ходе исследований по этой теме было установлено, что в стареющей эндотелиальной клетке происходит подъём активности цикла трикарбоновых кислот за счет увеличения синтеза -зависимые неспецифические миохондриальные поры( mPTP). В ходе исследований по этой теме было установлено, что в стареющей эндотелиальной клетке происходит подъём активности цикла трикарбоновых кислот за счет увеличения синтеза 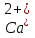 -зависимых дегидрогеназ, а их активация, возможно приводит увеличению общего уровня АФК, генерируемый митохондриями. Избыточное поступление ионов кальция осуществляется за счет эндоплазматическо-митохондриальной привязки. Для этого в свою очередь в стареющем эндотелиоците было характерно повышение белков ассоциированных с мембранами митохондрии и эндоплазматической сети, а при сверхпродукции закрепляющего белка RAB32 увеличивается поглощение кальция. Создав подобные условия в молодых эндотелиоцитах путём воздействия туникамицином , получаемые результаты будут схожи с результатами изучения стареющих клеток, поэтому можно сделать вывод, что воздействие на эндоплазматическую сеть эндотелиальной клетки является пусковым для старта возрастных изменений. -зависимых дегидрогеназ, а их активация, возможно приводит увеличению общего уровня АФК, генерируемый митохондриями. Избыточное поступление ионов кальция осуществляется за счет эндоплазматическо-митохондриальной привязки. Для этого в свою очередь в стареющем эндотелиоците было характерно повышение белков ассоциированных с мембранами митохондрии и эндоплазматической сети, а при сверхпродукции закрепляющего белка RAB32 увеличивается поглощение кальция. Создав подобные условия в молодых эндотелиоцитах путём воздействия туникамицином , получаемые результаты будут схожи с результатами изучения стареющих клеток, поэтому можно сделать вывод, что воздействие на эндоплазматическую сеть эндотелиальной клетки является пусковым для старта возрастных изменений.Роль нейтрофилов в продукции активных форм кислородаНейтрофилы являются важным компонентом иммунной системы, однако есть работы посвященные тому как эти клетки способствовали прогрессированию опухоли, генерируя активные формы кислорода и подавляя деятельность лимфоцитов. Нейтрофилы часто считаются гликолитическими, однако группа незрелых c-Kit+ клеток могут участвовать в митохондриальном метаболизме. Опухоли 4Т1 способны продуцировать c-Kit лиганд, что приводит к размножению нейтрофилов, способных поддерживать респираторный взрыв, когда доступ глюкозы ограничен, благодаря переходу на жирные кислоты, участвующие в поддержании НАДФ, а уровень АТФ следовал аналогичной схеме. Для установления того как опухоль может поддерживать способность нейтрофилов к производству активных форм кислорода ученые осуществляли блокаду передачи сигналов с-Kit, вводя исследуемым животным блокирующее антитело. На рост опухоли это никак не повлияло, но масса иммунокомпетентных органов и количество нейтрофилов всё-таки снизились, а последующее изучение вопроса о рои опухоли в качестве причины появления нейтрофилов, способных производить АКФ даже при дефиците глюкозы, позволяет сказать, что опухоль ответсвенна как за увеличение числа нейтрофилов, так и за их митохондриальную приспособленность. В работах, посвященных данной теме говорилось о возможном нахождении нейтрофилов в непосредственной близости или даже непосредственном контакте с лимфоцитами. В дальнейшем это подтвердилось: нейтрофилы были найдены вместе с CD4+ b CD4 лимфоцитами. В совокупости это показывает, что микроокружение опухоли способно индуцировать окислительные нейтрофилы для поддержания локальной иммунной супрессии. Роль антиоксидантной системыСодержание АФК контролируется компонентами антиокидантной системы, поддерживая тем самым равновесие между окислительными и антиокидантными элементами. Однако состояние этой системы может меняться по различным причинам, поэтому контроль за состоянием этой системы является одним из важных мероприятий. Механизмы антиоксидантной защиты состоят как из ферментативных, так и неферментативных систем, работающих вместе. За последние десять лет значительный прогресс был достигнут в изучении ферментативной системы защиты от АФК в митохондриях. Компоненты этой системы достаточно хорошо изучены и могут быть разделены на три группы. К первой группе относятся ферменты, не нуждающиеся в восстановительных эквивалентах для утилизации АФК, такие как супероксиддисмутаза 2 (Мn_SOD) и каталаза. Компоненты второй группы зависят от тиоредоксина (Trx) и тиоредоксинредуктазы (TRx2) для регенерации после взаимодействия с АФК. Ко второй группе относятся пероксиредоксины 3 и 5 (Prx3 и Prx5), локализованные в митохондриальном матриксе. Активность третьей группы зависит от глутатиона (GSH) и необходимой для его регенерации/восстановления глутатионредуктазы (GR). Данная группа включает в себя глутатионпероксидазу 1 (GPx1), глутатионпероксидазу 4 (GPx4) и глутаредоксины Колебания концентраций органических веществ в плазме может изменять эффективность антиоксидантной системы. Рассматривая вопросы взаимодействия АФК, сердечно-сосудистой системы и компонентов крови, логичным будет рассмотреть нарушение работы антиоксидантной системы на примере глюкозы, холестерина и липопротеинов. Работа антиокскидантной системы при гиперкликемии на примере сердцаХроническая гипергликемия остается основным причинным фактором развития сердечно-сосудистых заболеваний и сердечной недостаточности. Хроническая гипергликемия увеличивает выработку свободных радикалов, вызывая окислительный стресс. Аномальная продукция АФК вызывает усиление провоспалительного ответа, приводящего к апоптоззу кардиомиоцитов, а учитывая, что диабетическое сердце обладает сниженной митохондриальной антиоксидантной способностью и любые незначительные изменения в функции митохондрий могут привести к серьёзным изменениям в сердечной мышце, то это не удивительно. Однако сердце небеззащитно и способно противостоять воздействию активных форм кислорода с помощью эндогенных кардиозащитных механизмов: активация AMPK и Nrf2. АМРК представляет собой белок, состоящий из каталитической альфа и некаталитических бета и гамма субъединиц. Основной его функцией является сохранение АТФ или содействие альтернативным путям его генерации. Стимуляция белка приводит к фосфолирированию многих белков-мишений, важных для синтеза и утилизации АТФ, одновременно ингибируя пути потребления АТФ. В диабетическом сердце активация белка связана с фосфолирированием как ацетил-КоА-карбоксилазы, так и малонил-КоА-декарбоксилазы. Экспрессия генов антиоксидантного ответа регулируется редокс-чувствительным фактором транскрипции Nrf2. Активируемые гены могу быть разделены на детоксирующую и цитопротективную группы. В зону ответственности этого фактора транскрипции входит образование глутатиона, который реализует свою антиоксидантную функцию через образование дисульфидных связей. Работа антиоксидантной системы при атеросклерозеСосудистые клетки снабжены антиоксидантными защитными ферментами, позволяющими снизить окислительную нагрузку, возникающую при этом заболевании. В тканях млекопитающих синтезируется 3 изоформы супероксиддисмутазы. Однако здесь всё не так просто: снижение нагрузки создаваемой активными формами кислорода, будет происходить только в случае умеренной активации фермента, так как избыточная активность супероксиддисмутазы производит большое количество перекиси водорода, что может привести к образованию проатерогенных молекул, таких как гидроксильные радикалы. Каталаза катализирует восстановлние перекиси водорода до воды. Активные формы кислорода неоспоримо участвуют в атерогенезе, однако вклад разных АФК в этот процесс варьируется. Например, сверхэкспрессия каталазы даёт больший эффект, чем супероксиддисмутаза, так как, предположительно, атерогенные раздражители приводят к накоплению пероксидов, а не суперокидов. Нельзя не отметить работу параосоназ. Все 3 изофермента параоксаназы снижают окислительный стресс, уменьшают перекисное окисление при атеросклерозе, но с разными механизмами. Параоксоназа 1 ассоциируется с липидами высокой плотности и ингибирует образование окисленных форм липидов и, как следствие, липопротеинов низкой плотности, а сверхэкпрессия параоксаназы поражение сосудов. Параоксаназа 2 в плазме не обнаруживается, но её можно найти в сосудистой стенке. У человека наблюдается снижение экспрессии параоксаназы 2 в бляшках, по сравнению с тканями, примыкающим к бляшкам, что указывает на то, что защитный эффект параоксаназы 2 может не проявляться во время развития атеросклероза. Параоксназа 3 предотвращает окисление липопротеинов низкой плотности, как параоксаназа 1. Подобно параоксаназе 2, антиоксидантный эффект обусловлен предотвращением образования митохондриального супероксида из-за взаимодействия с убихиноном. Регуляция образования АФКВ митохондриях постоянно образуются и утилизируются активные формы кислорода, однако работа по их удалению выполняется так эффективно, что можно сказать, что митохондрия функционирует скорее как утилизатор, чем источник АФК. Дисбаланс в образовании и удалении активных форм кислорода приводит к окислительному стрессу, который играет роль а развитии многих заболеваний. Помимо всего вышесказанного о продукции и утилизации активных форм кислорода стоит осветить моменты, связанные с регуляцией этих процессов с помощью других соединений. В данной работе будут рассмотрены белки р66shc и Кlotho. Проокидантное действие p66shcДанный белок обладает прооксидантным действием. Считается, что это первый случай того, чтобы источник АФК был встроен в митохондрию с последующей активацией. Также есть данные о его возможном взаимодействии с цитохромом с, а именно возможность принимать с него электроны и отдавать их на кислород, функционируя как центр генерации АФК. Этот центр с редокс-потенциалом, намного превосходящим все остальные известные центры, должен быть способен к генерации АФК практически независимо от редокс-состояния митохондрий, задаваемого основными процессами метаболизма. Однако за годы изучения остался нерешённым целый ряд вопросов. Во-первых, не была убедительно показана необходимая для взаимодействия с цитохромом с локализация белка в митохондриальном межмембранном пространстве. Большая часть белка обнаруживается в микросомальной фракции (представляющей в основном эндоплазматический ретикулум), и его распределение между фракциями при дифференциальном центрифугировании полностью совпадало с распределением маркера эндоплазматического калнексина. С другой стороны, очень быстрый (за десятки секунд) ответ митохондрий с интактной внешней мембраной на добавление мутанта Ser36Asp может указывать на то, что взаимодействующий партнер p66shc находится снаружи митохондрий. Во-вторых, остается неясным, какая простетическая группа (если она существует) обеспечивает редокс-свойства p66shc. Это не может быть гем, т.к. его присутствие не проявляется в спектрах поглощения. В последовательности предполагаемого редокс-центра p66shc содержит всего один остаток цистеина (Cys81), что недостаточно для формирования железосерного кластера. Кроме того, высокий редокс-потенциал белка плохо совместим с предположением о реактивности самой тиоловой группы цистеина. В-четвертых, в предложенной модели утверждается, что p66shc принимает электроны с восстановленного цитохрома с и отдает их на кислород, однако в предложенном центре связывания цитохрома с больше катионных, чем анионных остатков, и, таким образом, он, скорее всего является положительно заряженным. Это должно приводить к отталкиванию (а не связыванию) положительного заряженного цитохрома с и находится в жестком противоречии с общепринятыми моделями связывания цитохрома с, которые базируются на электростатическом взаимодействии положительно заряженной поверхности цитохрома с отрицательно заряженными местами связывания на белке-партнере. Антиоксидантное действие белка KlothoДефицит Klotho связан с уменьшением продолжительности жизни и ускоренным старением сосудов, в то время как сверхэкспрессия обеспечивает защиту сосуда за счет снижения окислительного стресса. Белок может активировать уже упомянутый Nrf2, с помощью которого усиливает антиоксидантную защиту клеток, индуцируя ферменты гемоксигеназу, пероксиредоксин и образование восстановленного глутатиона. Существует регуляция между передачей сигналов Кlotho и Nrf2, а именно дефицит Klotho связан со снижением в печени цитоплазматических и ядерных уровней Nrf2, и наоборот, избыточная экспрессия Кlotho приводит к увеличению ядерного Nrf2 и активации антиоксидантных генов. На основании этого можно сделать вывод, растворимый Klotho является индуктором Nrf2.Помимо окислительного стресса, апоптоз VSMC способствует атерогенезу. Настоящее исследование демонстрирует, что растворимый Klotho защищает клетки гладких миоцитов аорты человека от ангиотензина II. Антиапоптотические и антиоксидантные эффекты Klotho ранее были продемонстрированы в культивируемых эндотелиальных клетках и, как сообщается, связаны с путями p53 / p21 и митоген-активируемой протеинкиназы. Активация ренин-ангиотензиновой системы является характерным событием в развитии сердечно-сосудистых заболеваний и связана с дефицитом Klotho. И наоборот, введение экзогенного растворимого Klotho может обеспечить защиту сердечно-сосудистой системы, притупляя активацию ренин-ангиотензиновой системой. Исследование деятельность белка Klotho представляет новый отчет об антиоксидантных, антиапоптотических и антистареющих эффектах, опосредованных активацией передачи сигналов к Nrf2 и индукцией антиоксидантных ферментов. Nrf2 играет роль в вазопротекции и, как известно, регулируется внутриклеточным окислительно-восстановительным статусом. Дополнительные исследования необходимы для дальнейшего выяснения клеточных сигнальных путей, которые связывают растворимый Klotho с передачей сигналов Nrf2. Участие в клеточной сигнализацииК настоящему времени накопилось немало сведений о сигнальной роли АФК. Они принимают участие в передаче внутриклеточных сигналов от различных факторов роста, способны изменять активность различных транскрипционных белков. Так, например, есть данные, что АФК участвуют в качестве сигнальных молекул при активации транскрипционных ядерных факторов AP-1 активирующий протеин-1) и NF-κB (nuclear factor κB — ядерный фактор каппа-би) и индукции экспрессии генов при иммунном ответе. АФК могут выступать в качестве индукторов клеточной гибели (апоптоза) или, наоборот, ингибировать цитотоксическое действие лекарственных препаратов на опухолевые клетки. Возможно, что АФК могут выступать в роли митотических стимуляторов, в небольших концентрациях стимулируя деление клеток различных тканей. Существуют также данные об участии АФК в регуляции редокс-статуса клетки и окислительных модификаций белков. Регуляция редокс-сигнализации может осуществляться как через общий уровень глутатиона (GSH) в клетке, так и через соотношение GSH/GSSH. Глутатион (трипептид Glu-Cys-Gly) нахо-дится почти во всех клетках в высокой концентрации и содержит нетипичную γ-связь между Glu и Cys. Восстановителем в этом соединении является тиольная группа цистеинового остатка. Две молекулы восстановленной формы (GSH) при окислении образуют дисульфид (GSSG). Окислительные модификации затрагивают, как правило, остатки цистеина в функциональных доменах различных белков, приводя к инактивации ферментов, изменению способности связывания транскрипционных факторов с ДНК и другим функциональным нарушениям. При понижении уровня восстановленного глутатиона нарушается проведение сигнала от ряда рецепторов факторов роста и связывание транскрипционных факторов с ДНК, подавляется рост и размножение клеток. АФК участвуют в начальных этапах клеточной сигнализации (редокс-сигнализация) в условиях стресса, гипоксии, воспаления и других патологических состояний. Характер клеточного ответапри этом будет зависеть от продолжительности и интенсивности воздействия вышеперечисленных факторов. При умеренном воздействии формируется неспецифический ответ, повышающий адаптацию организма к новым условиям. Механизм протекторного действия заключен, по-видимому, в окислительно-восстановительных модификациях сульфгидрильных групп сенсорных белков, что приводит к активации тирозинкиназного пути клеточного ответа. При воздействии высокой интенсивности, например, при глубокой гипоксии наступает некроз тканей, в том числе и за счет прямого повреждающего действия АФК, активирующих перекисное окисление липидов и других биологических молекул. Одним из важнейших следствий инициации редокс-сигнализации и АФК-опосредованной передачи сигнала является активация ядерных факторов транскрипции, которые находятся в неактивном состоянии до тех пор, пока в их молекуле не произойдет отщепление ингибиторного домена. После этого ядерные факторы транскрипции оказываются способными индуцировать многочислен-ные гены. Среди известных к настоящему времени белков, которые синтезируются в ответ на редокс-сигнал от адаптирующего фактора, наибольшее значение имеет, прежде всего, ряд неспецифических молекул, таких как ферменты антиоксидантной защиты, белки семейства HSP и другие белки срочного ответа, которые могут синтезироваться в ответ на гипоксию, стресс, ишемию, реперфузию. В процессе адаптации клетки к гипоксии АФК способствуют активации митохондриального АТФ-чувствительного калиевого канала и системы выброса калия из митохондрий, осуществляемого обычно К+/Н+-обменником, что свидетельствует об активации калиевого цикла в митохондриях. В то же время известно, что активация калиевого цикла способствует слабому разобщению митохондрий, которое ведет к снижению мембранного потенциала. А даже незначительное снижение мембранного потенциала ведет к существенному уменьшению продукции супероксид аниона. ЗаключениеИсследование активных форм кислорода в свете сердечно-сосудистой системы и компонентов крови представляет большой интерес как для отечественных ученых, так и для зарубежных. Изучая отношения органоидов клетки друг с другом и межклеточные взаимоотношения, исследователи углубляют свои знания в вопросе продукции АФК, что поможет составить общее представление о тех процессах, которые будут происходить в клетке при воздействии на нёе отравляющими веществами и старении. Продвижение работ, предметом которых является антиоксидантная система, позволит в тончайших подробностях изучить поведение каждого из её компонентов, так как индивидуальный подход к каждому из них открывает новые аспекты их деятельности. Обнаруживаемые пути регуляция продукции активных форм кислорода представляет собой возможность стать идеальным инструментом для исследования метаболизма АФК, что предоставит возможность фармакологического подхода к лечению патологий сердечно-сосудистой системы. Но не на все вопросы даны ответы, однако новые и интересные методологические подходы помогут продвинуть исследования, ведь знание патофизиологических и патобиохимических процессов, индуцируемых АФК, позволит проводить метаболическую и функциональную коррекцию изменений на уровне клеточных структур, предупреждая развитие органных и системных нарушений и, как следствие, развитие многих заболеваний. Список литературы
Выполнил: Курсант 2 курса 2 факультета рядовой Хлебников А.Ю. Проверил: Старший преподаватель к. м. н. Минаева Л. В |
