14билет. Молекулярное уравнение Na2S hoh Nahs NaOH
 Скачать 47.25 Kb. Скачать 47.25 Kb.
|
|
14билет 2) сигма связь- лобовое перекрывание облаков вдоль линии соединяющих ядра,образуется любыми орбиталями,связь прочная,еподвижная.Пи связь образуется только после сиг. связи,как вторая или третья,Связь непрочная, легко поляризуется. 3) кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Кислоты также можно разделить на сильные и слабые. Если в водном растворе кислота полностью распадается на ионы (диссоциирует), то она является сильной. Слабые кислоты не распадаются на ионы полностью, обычно их диссоциация протекает в незначительной степени. 4) Гидролиз – не реакция. Гидролиз – это обратимый и ступенчатый процесс, который идет в незначительной степени и заключается в: соль образованная слабой кислотой или основанием чуть-чуть разрушается водой, как результат гидролиза образуется кислая или щелочная среда. Молекулярное уравнение Na2S + HOH ⇄ NaHS + NaOH Полное ионное уравнение 2Na+ + S2- + HOH ⇄ Na+ + HS- + Na+ + OH- щелочная 5) - С повышением концентрации скорость увеличивается, т.к. число столкновений растет (1- если среди реагентов есть газы их концентрация прямо пропорционально зависит от давления, а значит скорость реакции тоже будет зависеть от давления; 2- если среди реагентов есть твердые вещества, их концентрация на скорость не влияет, скорость будет зависеть только от степени их измельчения или от площади поверхности соприкосновения с твердым веществом, т.к. реакция у твердых веществ идет только на поверхности); - С повышением температуры скорость всегда растет, т.к. сила и количество соударений растут; - Катализатор всегда увеличивает скорость реакции; Ингибитор – уменьшает скорость; - Скорость зависит от природы реагентов. 8) Способы выражения концентрации растворов. 1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. ωв =mв-ва/mр-ра*100% 2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V: m(р-ра)= С(x)* M(x)* V(р-ра) 3)Нормальность - количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов) Сн=𝑁=𝜈(экв)𝑉(р−ра)= 𝑚(в−ва)э∗𝑉(р−ра) моль/л m(в-ва)= Сн * Э * Vр-ра Э= M/ n*B n- число катионов В- валентность катионов 4) Титр раствора — масса растворённого вещества в 1 мл раствора. 9) m(Na2SO4) = w(Na2SO4) / 100 = (5 • 300) / 100 = 15 г где w(Na2SO4) – массовая доля в %, m - масса раствора в г m(H2O) = 300 г - 15 г = 285 г. 10) Билет 15 2) Гибридизация – процесс смешения электронной плотности разных по форме орбиталей внешнего слоя перед образованием связей. sp-гибридизация – форма линейная, валентный угол 180 градусов (пример, молекула C2H2). sp2 –гибридизация – форма плоский треугольник, валентный угол 120 градусов (пример, молекула C2H4). sp3 –гибридизация – форма тетраэдр, валентный угол 108 градусов и 4 минуты (пример, молекула C2H6). 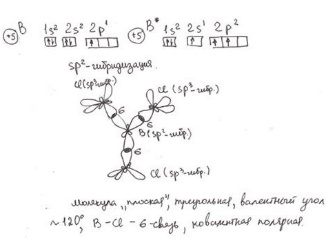 3)Зависит от концентрации р-ра, сстепень падает при при увел конценцен. Электролита ,от температуры и природы веществ. С повышение температуры степень дисс. Падает только у воды растет, электролиты делятся на сильные средние слабые,при разбавлении раствора воды степень увел.,так как равновесие смещается в сторону ионов. 1 ступень: H3PO4 = H(+) + H2PO4(-) К1 = [H+]*[H2PO4 -] / [H3PO4] 2 ступень: H2PO4(-) = H(+) + HPO₄(2-) 3 ступень: HPO4(2-) = H(+) + PO4(3-) 4) Молекулярное уравнение NaNO2 + HOH ⇄ HNO2 + NaOH Полное ионное уравнение Na+ + NO2- + HOH ⇄ HNO2 + Na+ + OH- 5)по принципу Ле Шателье повышение давления смещает равновесие в сторону меньшего газа. 8) Определение Электролиты - это химические соединения, которые могут растворяться в ионах при растворении в воде. это ионные соединения. Кислоты, основания и соли являются электролитами. могут проводить электричество через свои водные растворы. состоят из ионных связей. могут быть найдены как сильные электролиты и слабые электролиты. Неэлектролиты - это химические соединения, водные растворы которых не могут проводить электричество через раствор. не могут проводить электричество через свои водные растворы. состоят из ковалентных связей. соединений являются ковалентными соединениями. Углеродсодержащие соединения, жир и сахар являются неэлектролитами. Неэлектролиты не могут быть найдены в виде водорастворимых соединений и водонерастворимых соединений. 9) m=M ∙ n n=Cm ∙ V => m=M ∙ Cm ∙ V = 106 ∙ 0.1 ∙ 3 = 31,8 10) Индикаторы метода кислотно-основного титрования Индикаторами в методе кислотно-основного титрования служат вещества, меняющие свою окраску при изменении рН среды. Их называют кислотно-основными, или рН-индикаторами. Наиболее широко используются в анализе: метиловый оранжевый, фенолфталеин, лакмус, метиловый красный, тимолфталеин, бромтимоловый синий. БИЛЕТ22 1) 1)Заполнение энергетических подуровней электронами происходит таким образом, чтобы сумма n+l была минимальна, т.е. min(n+l)2)Если возможны два различных пути заполнения, при которых выполняется 1 правило, то реализуется тот путь, при котором минимально n, min(n).2) 2)Ковалентная связь – это спаривание непарных электронов и образование ОЭП, которая удерживает положительные ядра атомов. Механизмы образования ковалентной связи:При обменном механизме каждый из атомов отдаёт в общее пользование по одному неспаренному электрону. Таким образом построено большинство органических соединений.Ковалентная связь может быть образована также парой электронов, предоставляемой одним атомом, называемым донором электронов, и вакантной орбиталью другого атома, называемого акцептором электронов. Такой механизм образования ковалентной связи носит название донорно-акцепторным. 3) 1) Не будет реакции В растворе останется набор всех ионов - нет вещества, выводимого из сферы реакции, не образуется осадка, не выделяется газ, не образуется малодиссоциированное вещество BaCl2+K2CO3=BaCO3+2KCl Ba (+2) + 2Cl (-) + 2K (+) + CO3 (-2) = BaCO3=2K (+) + 2CL (-) Ba (+2) + CO3 (-2) = BaCO3 4)Гидролиз – не реакция. Гидролиз – это обратимый и ступенчатый процесс, который идет в незначительной степени и заключается в: соль образованная слабой кислотой или основанием чуть-чуть разрушается водой, как результат гидролиза образуется кислая или щелочная среда 8) Растворы – это гомогенные системы, состоящие из 2-х и более компонентов и продуктов их взаимодействия (гидратов, сальватов…). По агрегатному состоянию растворы бывают: -Жидкие (присутствует растворитель и растворенное вещество, если оба вещества жидкие, то растворитель тот, кого больше);Газообразные (например, воздух);Твердые (любые сплавы). Насыщенные р-ры: растворы, в которые невозможно растворить добавочное кол-во вещества, т.к. содержание в них растворенного вещ-ва максимально, в насыщенном растворе растворенное вещество находится в равновесии с его твердой формой 9) m(NaOH)=V*C*M=1 моль*1* 40 г/моль = 40 г. 10) Определение содержания (концентрации, массы) компонентов в анализируемом веществе называется количественным анализом. «Вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам». Это означает, что для того, чтобы вещества реагировали между собой без остатка, их надо брать в эквивалентных массах (объемах). Закону эквивалентов можно дать математическое выражение: 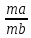 = = 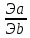 . . |
