Муромский институт
 Скачать 432.85 Kb. Скачать 432.85 Kb.
|
2.9 Прямой синтез из оксидов азотаПрямой синтез HNО3 основан на взаимодействии жидких оксидов азота с водой и газообразным кислородом под давлением до 5 МПа по уравнению 2N2O4 + O2 + 2H2O → 4HNO3. 100%-ный диоксид азота при атмосферном давлении и температуре 21,5 °С полностью переходит в жидкое состояние. При окислении аммиака полученный NO окисляется в NO2, содержание которого в газовой смеси составляет около 11%. Перевести диоксид азота такой концентрации в жидкое состояние при атмосферном давлении не представляется возможным, поэтому для сжижения оксидов азота применяют повышенное давление. Концентрирование азотной кислоты с помощью водоотнимающих веществ. Получить концентрированную азотную кислоту перегонкой разбавленной кислоты невозможно. При кипении и перегонке разбавленной азотной кислоты ее можно упарить лишь до содержания 68,4 % HNO3 (азеотропная смесь), после чего состав перегоняемой смеси не изменится В промышленности перегонку разбавленных водных растворов азотной кислоты осуществляют в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота, концентрированные растворы нитратов и др.). Применение водоотнимающих веществ дает возможность понизить содержание водяных паров над кипящей смесью и увеличить содержание паров азотной кислоты, при конденсации которых получается 98%-ная HNО3. Технологическая схема концентрирования азотной кислоты с применением серной кислоты показана на рисунке. 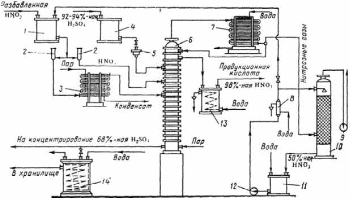 Схема концентрирования разбавленной азотной кислоты в присутствии серной кислоты 1, 4 – напорные баки для азотной и серной кислоты; 2 – контрольные фонари; 3 – испаритель разбавленной азотной кислоты; 5 – коробка для регулировании подачи кислоты;6 – концентрационная колонна, 7 – холодильник конденсатор; 8 – холодильник кислоты, циркулирующей в башне; 9 – вентилятор: 10 – поглотительная башня; 11 – сборник; 12 – насос; 13 – холодильник концентрированной азотной кислоты, 14 – холодильник отработанной серной кислоты Разбавленная азотная кислота из напорного бака 1 подается в колонну 6 через два расходомера 2, включенные параллельно. Один поток кислоты проходит в испаритель 3 и подается в виде смеси жидкости и пара на 10-ю тарелку колонны 6, другой поток без подогрева поступает на вышележащую тарелку. Серная кислота из напорного бака 4 через регулятор 5 подается в верхнюю часть колонны 6 выше ввода холодного потока азотной кислоты. В нижнюю часть колонны вводится острый пар, при нагревании которым из тройной смеси начинает испаряться азотная кислота. Пары азотной кислоты при температуре 70–85 °С, поднимаясь вверх, выходят через штуцер в крышке колонны и поступают в холодильник-конденсатор 7. В этих парах имеются примеси оксидов азота и воды. В холодильнике-конденсаторе пары азотной кислоты при температуре около 30 °С конденсируются с образованием 98–99%-ной HNО3, при этом оксиды азота частично поглощаются этой кислотой. Концентрированная азотная кислота, содержащая оксиды азота, направляется на две верхние тарелки и проходит их последовательно, причем оксиды выдуваются из раствора парами азотной кислоты, поступающими в конденсатор 7. Несконденсировавшиеся пары азотной кислоты и выделившиеся оксиды азота направляют на абсорбцию в башню 10, орошаемую водой. Полученная 50%-ная кислота поступает в сборник 11 и вновь направляется на концентрирование. Концентрированную азотную кислоту после охлаждения направляют на склад готовой продукции. Отработанная серная кислота, содержащая 65–85% H2SO4, поступает на концентрирование. При концентрировании азотной кислоты с применением 92–93%-ной серной кислоты расход последней значительно сокращается при подаче на концентрирование 59–60%-ной HNO3 вместо 48–50%-ной. Поэтому в некоторых случаях выгодно проводить предварительное концентрирование 50%-ной HNO3 до 60%-ной путем простого упаривания. Большим недостатком концентрирования азотной кислоты с помощью серной кислоты является высокое содержание паров и тумана H2SO4 в выхлопных газах после электрофильтров (0,3–0,8 г/м3 газа). Поэтому серную кислоту заменяют, например, нитратом магния или цинка. В некоторых случая используется концентрирование азотной кислоты с помощью нитрата магния. Этот способ концентрирования обеспечивает получение чистой концентрированной азотной кислоты без вредных выбросов в атмосферу. Однако у него есть ряд существенных недостатков, не позволяющих использовать такой способ повсеместно. В первую очередь это связано с повышенной по сравнению с другими способами себестоимостью получаемого продукта и проблемы утилизации трудно перерабатываемых твердых отходов. С ростом давления наблюдается снижение выхода оксида азота (II). Поэтому проектирование и сооружение установок с использованием повышенного давления на стадии конверсии аммиака сдерживались. Вместе с тем использование высокого давления при окислении аммиака позволяет повысить производительность агрегата, уменьшить размеры аппаратов. Этот факт в связи со стремлением к увеличению единичной мощности агрегатов приобретает все большее значение. На современных крупных агрегатах производства азотной кислоты процесс окисления аммиака осуществляется под давлением 0,41— 0,73 МПа. Основным условием получения высоких выходов NO под давлением выше атмосферного являются повышение температуры и времени контактирования (увеличение числа сеток). |
