Муромский институт
 Скачать 432.85 Kb. Скачать 432.85 Kb.
|
2.7 Катализаторы окисления аммиакаПревосходство платины по активности и селективности над всеми другими видами катализаторов было показано в 1902 г. Оствальдом. Характерно, что активность к реакции окисления аммиака проявляет подавляющее большинство металлов и их соединений, но высокий выход NO (выше 90%) обеспечивают очень немногие из них. Обладая высокой активностью и селективностью, платина имеет низкую температуру зажигания (около 200 °С), хорошую пластичность. Недостаток платины – ее быстрое разрушение при высоких температурах под воздействием больших скоростных потоков реагентов и катализаторных ядов. Это приводит к потерям дорогостоящего катализатора и снижению выхода NO, что и явилось причиной поисков каталитически активных сплавов платины с другими металлами. Используемые для контактного окисления NH3 катализаторы изготавливают в виде сеток. Такая форма катализатора удобна в эксплуатации, связана с минимальными затратами металла, позволяет применять наиболее простой и удобный в эксплуатации тип контактного аппарата. В России применяются сетки из проволоки диаметром 0,09 мм (ГОСТ 3193—74), размер стороны ячейки 0,22 мм, число ячеек на 1 см длины — 32, на 1 см2 — 1024. Платинородиевые (ГИАП-1) и платинородиевопалладиевые катализаторы весьма чувствительны к ряду примесей, которые содержатся в аммиаке и воздухе. К таким примесям относятся гидриды фосфора и мышьяка, фтор и его соединения, дихлорэтан, минеральные масла, ацетилен, диоксид серы, сероводород и др. Наиболее сильными ядами катализатора являются соединения серы и фтора. Примеси заметно снижают селективность катализатора, способствуют увеличению потерь платины. Для поддержания стабильной степени конверсии аммиака необходима тщательная очистка аммиачно-воздушной смеси и от механических примесей, особенно от оксидов железа и пыли железного катализатора синтеза аммиака. Пыль и оксиды железа, попадая на катализаторные сетки, засоряют их, уменьшая поверхность соприкосновения газов с поверхностью катализатора, и снижают степень окисления аммиака. В процессе реакции окисление аммиака поверхность платиноидных сеток сильно разрыхляется, эластичные нити сеток становятся хрупкими. При этом поверхность сетки увеличивается примерно в 30 раз Сначала это ведет к повышению каталитической активности катализатора, а затем к разрушению сеток. Практикой установлены следующие сроки работы катализаторных сеток: для работы под под давлением 0,73 МПа 8-9 мес. 2.8 Описание технологического процесса и схемы Азотная кислота – вещество, без которого невозможно представить индустрию минеральных удобрений, металлообработку, оргсинтез, производство красителей, золотопромышленность , ракетостроение и множество множество других отраслей. Потери аммиака на окисление до азота можно минимизировать, экспериментируя с катализатором, повышая его селективность (избирательность), доведя процентное соотношение продуктов в пользу оксида азота(2) до 97-98%. Реакция проходит на поверхности катализатора, то есть исходная аммиачновоздушная смесь контактирует с ним. Потому аппарат, в котором происходит процесс, так и называется – контактный. Реакция в контактном аппарате идёт с выделением большого количества тепла и необратима. Давление оказывает влияние на процесс, и это влияние негативное. Так как реакция происходит с увеличением объёма, избыточное давление «не даёт» этому объёму образоваться, снижает выход оксида азота. Однако чем выше давление – тем более интенсивнее происходит процесс в единице объёма, то есть с его увеличением аппараты можно строить гораздо меньшего размера. Так можно уменьшить скорость потока исходной воздушноаммиачной смеси, а это значит наши платиновые сетки будут гораздо меньше изашиваться. Также влияние на процесс оказывает и температура. Запускается реакция при 200 градусах, после чего реакционная смесь быстро нагревается за счёт теплового эффекта и её интенсивность падает. Чем выше температура смеси, тем меньше проявляется молекулы аммиака и кислорода взаимодействуют друг с другом. При нагреве процесс происходит более интенсивно за счёт более частых соударений молекул друг с другом. В этой системе противоположно влияющих факторов задача технологов и инженеров – найти золотую середину, чтоб и процесс шёл, и чтоб было дёшево. И сердито. В современных установках процесс в контактном аппарате ведут при давлении 40-70 атмосфер и температуре 800-1000 градусов. Есть ещё один технический момент – соотношение в исходной смеси аммиака и воздуха (кислорода). Её обычно делают не равновесной (пропрорционально количеству веществ, вступающих в реакцию), а смещают в сторону увеличения воздуха. Делается это по двум причинам. Первая – можно нечаянно (в случае тех или иных нарушений процесса) создать взрывоопасную смесь (да-да, аммиак с кислородом тоже может долбануть, что мало окружающим аппаратам и трубопроводам не покажется). Вторая – в избытке кислорода молекулам аммиака легче найти пару для реагирования, и процесс идёт с большим выходом по аммиаку, чем при равновесном соотношении. При получении в контактном аппарате окида азота NO необходимо сразу его охладить до температуры менее 200 градусов. Во-первых, 800-1000 градусов не слишком комфортны для работы со смесью, а во-вторых, реакция: 2NO + O2 ↔ 2NO2 Обратимая, и при 500 градусах практически полностью смещается в сторону исходных веществ. А в-третьих, в смеси кроме целевой реакции могут идти также побочные, из-за которых мы будем терять драгоценный оксид азота: NO + NO2 ↔ N2O3 2NO2 ↔ N2O4 Утилизацию лишнего тепла осуществляют в аппаратах, которые так и называются – «котлы-утилизаторы». Там смесь, отдавая тепло, нагревает воду, превращая её в пар, а после «догоняется» в водяных холодильниках до комфортных 30 градусов. В результате реакции в контактном аппарате выделяется вода, и теперь, в комфортных условиях, эта вода взаимодействует с получающимся NO2, с образованием небольшого количества прилично концентрированной азотной кислоты. 4NO2 +O2 + 2H2O= 4HNO3 Дальше газовая смесь поступает в абсорбционные аппараты. Газовая смесь барботирует, проходя через слой воды на на тарелках, и NO2, содержащийся в ней, вступает в реакцию с образованием азотной и азотистой кислот: 4NO2 + 2H2O = 3HNO3 + HNO2 Азотистая кислота тут же постепенно окисляется кислородом воздуха из смеси до азотной: 2HNO2 + O2 = 2HNO3 Таким образом, газовая смесь, поднимаясь вверх, становится всё менее насыщенной оксидом азота, а вода, стекая вниз, становится всё более и более обогащённой азотной кислотой. Регулируя высоту колонны и концентрации исходных веществ в смеси можно получить азотную кислоту любой концентрации. В массовом производстве предпочитают удерживать концентрацию на выходе из абсорберов в 65-68%, ибо это дешевле, чем делать высококонцентрированную, да по большому счёту и не нужно – география приминения концентрированной азотной кислоты значительно меньше разбавленной. Процесс получения неконцентрированной (слабой) азотной кислоты заключается в окислении газообразного аммиака кислородом под атмосферным давлением в присутствии катализатора и абсорбция окислов азота водой под давлением – 2,5 кгс/см2. В основу схемы положен замкнутый энерготехнологический цикл с двухступенчатой конверсией аммиака и охлаждением нитрозных газов под давлением 0,42–0,47 МПа и абсорбцией оксидов азота при давлении 1,1—1,26 МПа; продукция выпускается в виде 60%-ной HNO3. Принципиальная технологическая схема процесса приведена на рисунке. 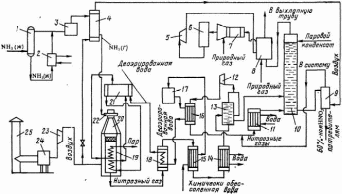 Технологическая схема производства азотной кислоты: 1 – ресивер; 2 – испаритель; 3, 24 – фильтры; 4, 15 – подогреватели; 5 – рекуперационная турбина; 6 – реактор каталитической очистки; 7 – смеситель; 8 – топочное устройство; 9 – продувочная колонна; 10 – абсорбционная колонна, II, 14 – водяные холодильники; 12, 23 – компрессоры; 13 – газовый промыватель; 16, 18 – холодильники нитрозных газов; 17 – деаэрационная колонна; 19 – котел-утилизатор; 20 – контактный аппарат; 21 – барабан с сепарационным устройством; 22 – смесительная камера; 25 – труба для забора воздуха Воздух забирают из атмосферы через трубу 25, очищают от пыли в фильтре 24, сжимают воздушным компрессором 23 до 0,42 МПа и, разделив на два потока, подают в контактный аппарат и подогреватель аммиака. Жидкий аммиак (парожидкостная смесь) через ресивер 1 поступает в испаритель 2, где испаряется при 10–16 °С и давлении 0,6 МПа. После испарителя газообразный аммиак очищают от масла и механических примесей в фильтре 3 и направляют в подогреватель аммиака 4, где он нагревается до 80–120 °С воздухом. Очищенный воздух и аммиак поступают в смесительную камеру 22 контактного аппарата 20. Образующаяся аммиачно-воздушная смесь содержит 9,6–10,0% NH3. Пройдя тонкую очистку в фильтре, встроенном в контактный аппарат, аммиачно-воздушная смесь поступает на двухступенчатый катализатор, состоящий из трех платиноидных сетоь и слоя неплатинового катализатора. Нитрозные газы при температуре 840–860 °С поступают в котел-утилизатор 19, расположенный под контактным аппаратом, где за счет их охлаждения получают пар давлением 40 МПа с температурой 440 °С. Котел питают химически очищенной водой, деаэрированной в колонне 17. Деаэрированная вода проходит теплообменник 16, где нагревается нитрозными газами до 150 °С, экономайзер 18 и затем поступает в барабан котла-утилизатора 21. Нитрозные газы после котла-утилизатора охлаждаются в экономайзере 18, отдают свою теплоту в подогревателе 15 и затем поступают в водяной холодильник 14 для дальнейшего охлаждения до 55 СС. При охлаждении нитрозных газов происходит конденсация паров воды с образованием 40–45%-ной азотной кислоты, которая подается в газовый промыватель 13. Сюда же поступают нитрозные газы. В промывателе происходит одновременно с охлаждением промывка нитрозных газов от ндтрит-нитратных солей и дальнейшая конденсация азотной кислоты. Кислота из нижней части промывателя подается в абсорбционную колонну 10, а нитрозные газы сжимаются в компрессоре 12 до 11–12,6 МПа, нагреваясь при этом до 210–230 °С. После сжатия нитрозные газы охлаждают в холодильнике 16 до 155–165 °С. в холодильнике 11 второй ступени до 60–65 °С и подают в абсорбционную колонну 10. На тарелках колонны расположены земеевики для охлаждения кислоты. Сверху в колонну поступает паровой конденсат (Н2O) с температурой не выше 40 °С. Снизу колонны выводится 58–60%-ная азотная кислота; она поступает в продувочную колонну 9 для удаления растворенных в ней оксидов азота и далее направляется в хранилище Отходящий газ из абсорбционной колонны нагревается в подогревателе (топочном устройстве) 8, смешивается в смесителе 7 с природным газом и подогретый до 480 °С направляется на каталитическую очистку от оксидов азота в реактор. Катализатором очистки служит алюмопалладиевый катализатор АПК-2. После каталитического разложения выхлопные газы, содержащие до 0,008% оксидов азота при температуре 750 °С, поступают в рекуперационную турбину 5, входящую в состав газотурбинного агрегата. Здесь тепловая энергия выхлопных газов преобразуется в механическую с одновременным снижением давления газа до 0,95–1,05МПа. Энергия, вырабатываемая в газовой турбине, используется для привода компрессоров 12 и 23 (нитрозного и воздушного). Производство слабой азотной кислоты под повышенным давлением. В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной каталитической очистки выхлопных газов, выпускающий продукцию в виде 53-58%-ной HNO3 . При разработке этой схемы были пересмотрены вопросы экономической эффективности производства по схеме, в результате чего уменьшена мощность установки с 380 тыс. тонн до 120 тыс. тонн в год и снижено давление во всей схеме. В частности, абсорберы работают при давлении 0,5–0,7 МПа. Улучшена схема очистки хвостовых газов |
