Реферат по биоэтике. Несут ли угрозу здоровью человека опыты в генной инженерии
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
ФГБОУ ВО «Марийский государственный университет» Медицинский университет Реферат на тему «Несут ли угрозу здоровью человека опыты в генной инженерии» Выполнил студент 2 курса Николаев Денис Группа ЛД-23 Йошкар-Ола 2021 План Что такое генная инженерия и что она изучает? Для чего нужна генная инженерия? История генной инженерии Объекты в генной инженерии Методы генной инженерии Безопасна ли генная инженерия? Научные факты опасности генной инженерии Биоэтические проблемы Этапы создания транс генного организма Будущее генной инженерии Вывод… Что такое генная инженерия? Как известно, наследственные признаки любого живого существа записаны в каждой клетке организма в виде совокупности генов – элементов сложных белковых молекул РНК и ДНК. Вводя в геном живого существа чужеродный ген, можно изменить свойства получаемого организма, причём в нужную сторону: сделать сельскохозяйственную культуру более устойчивой к морозу и болезням, придать растению новые свойства и т.д. Организмы, полученные в результате такой переделки, называются генно-модифицированными, или транс генными, а научная дисциплина, занимающаяся исследованием модификаций генома и разработкой транс генных технологий – генетической или генной инженерией. Генная инженерия – это раздел молекулярной генетики, связанный с целенаправленным созданием новых комбинаций генетического материала (рекомбинантной ДНК) , способного к воспроизводству и функционированию в клетке хозяине. Для чего нужна генная инженерия? К середине ХХ века традиционные методы селекции перестали устраивать учёных, так как это направление обладает рядом серьёзных ограничений: С помощью транс генных технологий можно создавать организмы с заданными свойствами, заменяя отдельные участки генома другими, взятыми у живых существ, принадлежащих к другим видам. При этом сроки создания новых организмов существенно сокращаются. Необязательно закреплять нужные признаки, делая их наследуемыми, так как всегда есть возможность генетически модифицировать следующие партии, поставив процесс буквально на поток. История генной инженерии Генная инженерия появилась благодаря работам многих исследователей в разных отраслях биохимии и молекулярной генетики. На протяжении многих лет главным классом макромолекул считали белки. Существовало даже предположение, что гены имеют белковую природу. Лишь в 1944 году Эйвери, Мак Леод и Мак Карти показали, что носителем наследственной информации является ДНК. С этого времени начинается интенсивное изучение нуклеиновых кислот. Спустя десятилетие, в 1953 году Дж. Уотсон и Ф. Крик создали двуспиральную модель ДНК. Именно этот год принято считать годом рождения молекулярной биологии. На рубеже 50 - 60-х годов были выяснены свойства генетического кода, а к концу 60-х годов его универсальность была подтверждена экспериментально. Шло интенсивное развитие молекулярной генетики, объектами которой стали ее вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов. ДНК вирусов и плазмид вводили в клетки в биологически активной форме, обеспечивая ее репликацию и экспрессию соответствующих генов. В 70-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК. Особая роль в развитии методов генной инженерии принадлежит рестриктазам и ДНК-лигазам. Историю развития генетической инженерии можно условно разделить на три этапа. генный клонированный плазмид рестриктаза Первый этап связан с доказательством принципиальной возможности получения рекомбинантных молекул ДНК in vitro. Эти работы касаются получения гибридов между различными плазмидами. Была доказана возможность создания рекомбинантных молекул с использованием исходных молекул ДНК из различных видов и штаммов бактерий, их жизнеспособность, стабильность и функционирование 1938 г.-Г. Шпеманн использует ядра клеток зародыша саламандры для клонирования идентичных близнецов. 1945-1950 гг.-выращиваются первые клеточные культуры животных. 1953 г.-Р. Бриггс и Т. Кинг сообщили об успешной разработке метода «нуклеотрансфера»-переноса ядра клетки в гигантские икринки африканской шпорцевой лягушки «ксенопус». 50-е годы 20 века - выращены первые клеточные культуры человека; проводится искусственное оплодотворение домашнего скота с помощью замороженной спермы; обнаружены плазмиды бактерий. 1970 г.-Г. Смит и В. Арбер выделили рестриктазу. 1972 г.-П. Берг получил in vitro рекомбинантную ДНК, состоящую из фрагментов ДНК вируса обезьян sv-40, ДНК бактерии E.coli и ДНК фага л. Второй этап связан с началом работ по получению рекомбинантных молекул ДНК между хромосомными генами прокариот и различными плазмидами, доказательством их стабильности и жизнеспособности. 1973 г.-Л. Шетлз из Колумбийского университета Нью-Йорка заявил, что он готов произвести на свет первого «бэби из пробирки», после чего последовали запреты Ватикана и пресвитерианской церкви США. 1975 г.-Ф. Сэнгер предложил первый прямой метод определения последовательности ДНК. 1975г.-Э. Саузерн и Р. Дейвис разработали метод, который позволяет идентифицировать конкретные гены и другие рестрикционные фрагменты ДНК после их электрофоретического разделения. 1977 г.-Дж. Коллинзом и Б. Холманом разработан метод клонирования ДНК с использованием космид. 1977 г.-А. Максамом и У. Гилбертом разработан метод секвенирования ДНК. 1978г.-создан генно - инженерный инсулин, который практически полностью идентичен естественному белку. Это открытие позволило спасти миллионы жизней больных диабетом. 1978 г.- синтезирован генно-инженерный гормон роста человека. 1978г.- рождение в Англии Луизы Браун, первого ребенка «из пробирки». Третий этап - начало работ по включению в векторные молекулы ДНК (ДНК, используемые для переноса генов и способные встраиваться в генетический аппарат клетки-рецепиента) генов эукариот, главным образом, животных. Формально датой рождения генетической инженерии следует считать 1972 год, когда в Стенфордском университете П. Берг, С. Коэн, Х. Бойер с сотрудниками создали первую рекомбинантную ДНК, содержавшую фрагменты ДНК вируса SV40, бактериофага и E. coli. 1979 г.- завершена публикация серии статей о работах профессора Оксфордского университета Дж. Гердона, в ходе которых было клонировано 50 лягушек. 1981 г.- К. Илмензе и П. Хоппе получили серых мышей, перенеся ядра клеток серого зародыша в цитоплазму яйцеклетки, полученной от черной самки, после чего эмбрионы были перенесены в белых самок, которые и выносили потомство. 4 января 1985 г.- в одной из клиник Лондона родилась девочка у миссис Коттон-первой суррогатной матери («бэби Коттон», как назвали девочку, была зачата не из яйцеклетки миссис Коттон). Был вынесен парламентский запрет на эксперименты с человеческими эмбрионами старше 14 дней. 1986 г.- создана генно-инженерная вакцина против гепатита В и генно-инженерный интерферон против различных вирусных заболеваний и злокачественных новообразований. 1987 г.- первые полевые испытания генетически модифицированных сельскохозяйственных растений (томат, устойчивый к вирусным заболеваниям). 1990 г.- начало международного проекта по созданию генетической карты человека (Human Genom Project). 1990 г.- проведена успешная генная терапия, спасшая жизнь четырехлетней девочке, с нарушением иммунитета. 1993 г.- генетически измененные продукты допущены на прилавки магазинов мира. 1993 г.- К. Мюллис за разработку метода полимеразной цепной реакции (ПЦР) удостоен звания лауреата Нобелевской премии. 1997 г.- журнал «Сайенс» сообщает о рождении шести овец, полученных по рослинскому методу. Три из них, в том числе и овечка Полли, несли человеческий ген «антигемофильного фактора IX». 1998 г.- успешно выращиваются эмбриональные стволовые клетки; создана полная генетическая карта животного (секвенирование генома «Круглого червя»). 1998 г.- французские ученые объявили о рождении клонированной телочки. 2001 г.- создана первая полная генетическая карта сельскохозяйственного растения (риса). 2002 г.- почти полностью расшифрован геном человека. Объекты генной инженерии Наиболее часто объектами для исследования генной инженерии становятся микроорганизмы, клетки растений и низших животных, однако ведутся исследования и на клетках млекопитающих, и даже на клетках человеческого организма. Как правило, непосредственным объектом исследования является молекула ДНК, очищенная от прочих клеточных веществ. При помощи энзимов ДНК расщепляется на отдельные отрезки, причём важно уметь распознавать и выделять нужный отрезок, переносить его при помощи энзимов и встраивать в структуру другой ДНК. Современные методики уже позволяют достаточно свободно манипулировать отрезками генома, размножать нужный участок наследственной цепи и вставлять его на место другого нуклеотида в ДНК реципиента. Накоплен достаточно большой опыт и собрана немалая информация по закономерностям строения наследственных механизмов. Как правило, преобразованиям подвергаются сельскохозяйственные растения, что уже позволило существенно повысить результативность основных продовольственных культур. Безопасна ли генная инженерия? Вопрос, насколько безопасны трансгенные технологии, периодически поднимается как в научной среде, так и в СМИ, далёких от науки. Однозначного ответа на него нет до сих пор. Во-первых, генная инженерия остаётся ещё достаточно новым направлением биотехнологий, и статистика, позволяющая делать объективные выводы об этой проблеме, пока что не успела накопиться. Во-вторых, огромные вложения в генную инженерию со стороны транснациональных корпораций, занимающихся производством продуктов питания, могут служить дополнительной причиной отсутствия серьёзных исследований. Впрочем, в законодательствах многих стран появились нормы, обязывающие производителей указывать наличие продуктов из ГМО на упаковке товаров пищевой группы. В любом случае, генная инженерия уже продемонстрировала высокую результативность своих технологий, а её дальнейшее развитие обещает людям ещё больше успехов и достижений. Научные факты опасности генной инженерии 1. Генная инженерия в корне отличается от выведения новых сортов и пород. Искусственное добавление чужеродных генов сильно нарушает точно отрегулированный генетический контроль нормальной клетки. Манипулирование генами коренным образом отличается от комбинирования материнских и отцовских хромосом, которое происходит при естественном скрещивании. 2. В настоящее время генная инженерия технически несовершенна, так как она не в состоянии управлять процессом встраивания нового гена. Поэтому невозможно предвидеть место встраивания и эффекты добавленного гена. Даже в том случае, если местоположение гена окажется возможным установить после его встраивания в геном, имеющиеся сведения о ДНК очень неполны для того, чтобы предсказать результаты. 3. В результате искусственного добавления чужеродного гена непредвиденно могут образоваться опасные вещества. Это могут быть токсические вещества, аллергены или другие вредные для здоровья вещества. Сведения о подобного рода возможностях ещё очень неполны. 4. Не существует совершенно надёжных методов проверки на безвредность. Более 10% серьёзных побочных эффектов новых лекарств не возможно выявить несмотря на тщательно проводимые исследования на безвредность. Степень риска того, что опасные свойства новых, модифицированных с помощью генной инженерии продуктов питания, останутся незамеченными, вероятно, значительно больше, чем в случае лекарств. 5. Существующие в настоящее время требования по проверке на безвредность крайне недостаточны. Они совершенно явно составлены таким образом, чтобы упростить процедуру утверждения. Они позволяют использовать крайне нечувствительные методы проверки на безвредность. Поэтому существует значительный риск того, что опасные для здоровья продукты питания смогут пройти проверку незамеченными. 6. Созданные до настоящего времени с помощью генной инженерии продукты питания не имеют сколько-нибудь значительной ценности для человечества. Эти продукты удовлетворяют, главным образом, лишь коммерческие интересы. Биоэтические проблемы Возможными биоэтическими проблемами применения генной инженерии являются проблемы неравенства, проблемы изменения самосознания, самопонимания индивидов, изменения идеалов, изменения человеческой сущности, проблемы отношения детей и родителей, проблемы ценности человеческой жизни, проблемы создания биологического и «этнического» оружия. Этапы создания трансгенного организма 1)Выделение изолированного гена с нужными свойствами. Сегодня для этого существуют достаточно надёжные технологии, есть даже специально подготовленные библиотеки генов. 2)Ввод гена в вектор для переноса. Для этого создаётся специальная конструкция – трансген, с одним или несколькими отрезками ДНК и регуляторными элементами, который встраивается в геном вектора и подвергается клонированию при помощи лигаз и рестриктаз. В качестве вектора обычно используются кольцеобразные бактериальные ДНК – плазмиды. 3)Встраивание вектора в организм реципиента. Этот процесс скопирован с аналогичного природного процесса встраивания ДНК вируса или бактерии в клетки носителя и действует таким же образом. 4)Молекулярное клонирование. При этом клетка, подвергшаяся модификации, успешно делится, производя множество новых дочерних клеток, которые содержат изменённый геном и синтезируют белковые молекулы с заданными свойствами. 5)Отбор ГМО. Последний этап ничем не отличается от обычной селекционной работы. Будущее генной инженерииВ ноябре 2017 Брайан Мадо стал первым человеком, испытавшим на себе терапию по редактированию генов. У 44-летнего мужчины из Феникса, штат Аризона, в детстве был диагностирован синдром Хантера – редкое генетическое заболевание, связанное с нарушением выработки ферментов, необходимых для расщепления мукополисахаридов. Смысл терапии состоит в замещении повреждённых генов в печени мужчины здоровыми при помощи так называемых «молекулярных ножниц», которые вводят в организм внутривенно. Предварительные результаты терапии показали улучшение состояния Брайана и пяти других пациентов, также получивших инъекции, редактирующие их гены, что ознаменовало революцию не только в медицине, но и на рынке труда.  В ноябре 2017 Брайан Мадо стал первым человеком, испытавшим на себе терапию для редактирования генов. В ноябре 2017 Брайан Мадо стал первым человеком, испытавшим на себе терапию для редактирования генов. У 44-летнего мужчины из Феникса, штат Аризона, в детстве был диагностирован синдром Хантера – редкое генетическое заболевание, связанное с нарушением выработки ферментов, необходимых для расщепления мукополисахаридов. У 44-летнего мужчины из Феникса, штат Аризона, в детстве был диагностирован синдром Хантера – редкое генетическое заболевание, связанное с нарушением выработки ферментов, необходимых для расщепления мукополисахаридов. Смысл терапии состоит в замещении повреждённых генов в печени мужчины здоровыми при помощи так называемых «молекулярных ножниц», которые вводят в организм внутривенно. Смысл терапии состоит в замещении повреждённых генов в печени мужчины здоровыми при помощи так называемых «молекулярных ножниц», которые вводят в организм внутривенно.Постепенно технология применения генной терапии выходит за рамки исследовательских лабораторий, вследствие чего необходимость в специалистах в сфере генной инженерии будет только расти. Правительство Соединённого Королевства ожидает, что к 2030 году только в Британии будет создано более 18 тысяч новых рабочих мест для обслуживания генной и клеточной терапии. По оценкам Бюро статистики труда США количество рабочих мест для инженеров-биомедиков вырастет на 7%, а для исследователей в сфере биотехнологий на 13%, что в сумме составляет около 17,5 тысяч мест.  Бюро статистики труда США Бюро статистики труда СШАГенная терапия стремительно развивается и в скором времени станет одной из самых значительных отраслей медицины. Для полноценной деятельности индустрии необходимы специалисты не только медицинской сферы (генетики, молекулярные биологи, вирусологи, биоинженеры, инженеры-биохимики), но и менеджеры, экономисты, юристы и многие другие. Генная индустрия – серьёзный бизнес, на разработку, изучение и множественные эксперименты ежегодно выделяются миллиарды долларов, поскольку в применении терапии, редактирующей гены человека, правительства многих стран видят будущее медицины. На сегодняшний день многие генетически обусловленные заболевания (например, гемофилия или муковисцидоз) неизлечимы и смертельны, существующие технологии позволяют лишь поддерживать жизнь больных и не всегда гарантируют приемлемое качество жизни.  В настоящее время во всём мире проводится около 2700 клинических исследований с использованием генной терапии, направленных на лечение различных заболеваний (рака, мышечной дистрофии, серповидноклеточной анемии и др.). Всемирно известные фармацевтические компании, включая Bayer, GlaxoSmithKline, Pfizer, Merck и Novartis, заинтересованы в успехе подобных клинических испытаний, в связи с чем они активно расширяют штат сотрудников. Работодатели требуют от соискателей высочайшего уровня навыков и знаний и обещают соответственную оплату труда: например, генетик может рассчитывать на сумму от 39 870 до 134 770 долларов в год, а биоинформатик (специалист, который отвечает за толкование генетической информации) будет зарабатывать от 35 620 до 101 030 долларов, согласно данным, предоставленным Национальным Институтом Генетических Исследований.  Потенциал генной инженерии во многих странах ограничен из-за этических вопросов: в Европе любые манипуляции с генами живых организмов – растений, животных, людей – строго контролируются, в США политика правительства более лояльна. Главной этической проблемой считается изменение генов на этапе зачатия или эмбрионального развития – помимо возможности искоренить заболевания, передающиеся по наследству, генная инженерия в будущем позволит выбирать пол, цвет волос и глаз, рост и прочие черты – именно этот факт и вызывает разногласия.  Несмотря на очевидную пользу применения терапии замены дефективных генов, ожидается, что не все пациенты будут чувствовать себя комфортно, позволяя науке вмешиваться в их код ДНК. В таком случае пациенту необходима психологическая поддержка специалиста, который смог бы доступно объяснить все нюансы процедуры и помочь принять решение, учитывая возможные риски – консультанта по генетике. Сегодня их роль в основном заключается в оказании помощи пациентам, столкнувшимся с генетическими заболеваниями и желающими узнать, мутация какого гена стала причиной заболевания и является ли оно наследственным. Данная специальность появилась сравнительно недавно, но по мере развития генной инженерии будет расти необходимость в специалистах этого профиля – к 2026 году количество рабочих мест для консультантов по генетике вырастет на 29%.   На сегодняшний день лидером в сфере генетической инженерии является Китай, терапия замены дефективных генов была успешно применена на 86 пациентах, больных раком и ВИЧ. В начале 2018 правительство КНР одобрило клиническое исследование с использованием технологии редактирования генов CRISPR-Cas9, в котором примут участие 300 пациентов с различными генетическими заболеваниями. Данная технология позволяет удалять неправильные последовательности генов в клетках высших организмов с помощью иммунной системы бактерий, чтобы впоследствии заменить их здоровыми. CRISPR-Cas9 была открыта 5 лет назад и стала причиной настоящего фурора в медицине, поскольку она стимулировала поиск дефективных генов, отвечающих за различные генетические заболевания.  Принцип работы технологии CRISPR-Cas9 Принцип работы технологии CRISPR-Cas9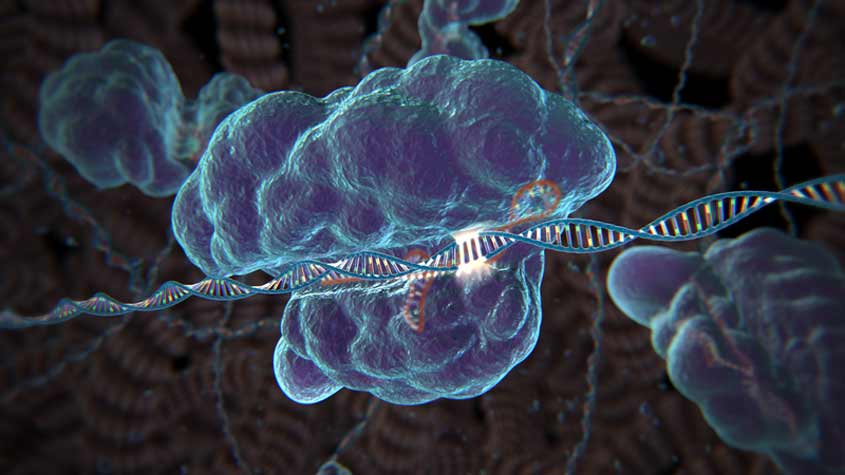 Вывод. В настоящее время генная инженерия технически несовершенна, так как она не в состоянии управлять процессом встраивания нового гена. Поэтому невозможно предвидеть место встраивания и эффекты добавленного гена. Знания о наследственном веществе, ДНК, очень неполны. Известно о функции лишь трёх процентов ДНК. Рискованно манипулировать сложными системами, знания о которых недостаточны. Обширный опыт в области биологии, экологии и медицины показывает, что это может вызвать серьёзные, порой непредсказуемые проблемы и расстройства. В результате искусственного добавления чужеродного гена непредвиденно могут образоваться опасные вещества. В худшем случае это могут быть токсины, аллергены или другие вредные для здоровья вещества. Созданные до настоящего времени с помощью генной инженерии продукты питания не имеют сколько-нибудь значительной ценности для человечества. Эти продукты удовлетворяют, главным образом, лишь коммерческие интересы производителей. Могут возникнуть новые и опасные вирусы. Экспериментально доказано, что встроенные в геном гены вирусов могут соединяться с генами инфекционных вирусов (так называемая рекомбинация). Такие новые вирусы могут быть более агрессивными, чем исходные. Вирусы растений могут стать вредными для полезных насекомых, животных, а также людей. |
