|
|
Физика1_ПЗ 2_Егоров А.В.. Один моль идеального газа переходит из начального состояния 1 в конечное состояние 3 в результате изохорного 12 и изобарного 23 процессов
 МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«Тольяттинский государственный университет»
(наименование института полностью)
Кафедра Автомобили и автомобильный сервис
(наименование кафедры/департамента/центра полностью)
23.03.03
(код и наименование направления подготовки, специальности)
Эксплуатация транспортно-технологических машин и комплексов
(направленность (профиль) / специализация)
Практическое задание №2
по учебному курсу «Физика 1»
(наименование учебного курса)
Вариант 6
Студент
|
А.В. Егоров
|
|
|
(И.О. Фамилия)
|
|
Группа
|
ЭТКбд-2002ас
|
|
|
|
|
Преподаватель
|
А.П. Павлова
|
|
|
(И.О. Фамилия)
|
|
Тольятти 2022
Задача 1
Один моль идеального газа переходит из начального состояния 1 в конечное состояние 3 в результате изохорного 1-2 и изобарного 2-3 процессов. Значения давления и объёма газа в состояниях 1 и 3 равны соответственно 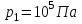 , ,
 30 л и 30 л и  , ,  20 л. Найти давление, объём и температуру газа 20 л. Найти давление, объём и температуру газа  в промежуточном состоянии 2. Изобразить процессы в координатах P - V, P - T и V - T. в промежуточном состоянии 2. Изобразить процессы в координатах P - V, P - T и V - T.
Дано:


 30л=30*10-3м3 30л=30*10-3м3
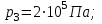
 20л=20*10-3м3 20л=20*10-3м3
|
Решение:
Поскольку процесс 1-2 изохорный, то 𝑉1=𝑉2=30*10-3м3
Поскольку процесс 2-3 изобарный, то 
Запишем уравнение Менделеева для второго состояния газа:

Где  - универсальная газовая постоянная. - универсальная газовая постоянная.
Подставим численные значения и произведём вычисления:
 = 722К = 722К
Для состояния 1 запишем уравнение Менделеева – Клапейрона:

Подставим численные значения и произведём вычисления:
 = 361 К = 361 К
Для состояния 3 запишем уравнение Менделеева – Клапейрона:

Подставим численные значения и произведём вычисления:
|
Найти:


Изобразить:
P - V
P - T
V - T
|
 = 481 К = 481 К
Для построения графиков процессов запишем параметры газа в каждой точке.
В 1-й точке - Т₁= 361 К, 𝑝₁=10⁵ Па, 𝑉₁= 30*10-3м3
Во 2-й точке – Т2= 722 К, 𝑝2= 2*10⁵ Па, 𝑉2= 30*10-3м3
В 3- й точке – Т3= 481 К, 𝑝3= 2*10⁵ Па, 𝑉3= 20*10-3м3
Изобразим процесс в координатах P – V.

Изобразим процесс в координатах P – Т.

Изобразим процесс в координатах V – Т.

О твет: Т2= 722 К, 𝑝2= 2*10⁵ Па, 𝑉2= 30*10-3м3 твет: Т2= 722 К, 𝑝2= 2*10⁵ Па, 𝑉2= 30*10-3м3
|
Задача 2.
Идеальный газ -  совершает замкнутый цикл, состоящий из трех процессов: изобарного 1 - 2, адиабатного 2 - 3 и изотермического 3 - 1, идущий по часовой стрелке. Значения давления и объёма газа в состояниях 1, 2 и 3 равны соответственно совершает замкнутый цикл, состоящий из трех процессов: изобарного 1 - 2, адиабатного 2 - 3 и изотермического 3 - 1, идущий по часовой стрелке. Значения давления и объёма газа в состояниях 1, 2 и 3 равны соответственно 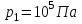 , ,  , и , и  . Найти термический к.п.д. цикла. . Найти термический к.п.д. цикла.
Дано:



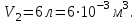
|
Решение:
КПД цикла вычисляется по формуле:
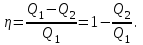
Где  - количество теплоты, переданное газу за цикл от нагревателя; - количество теплоты, переданное газу за цикл от нагревателя;  - количество теплоты, отданое газом за цикл холодильнику. - количество теплоты, отданое газом за цикл холодильнику.
Работа газа при изобарном процессе вычисляется по формуле:
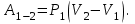
Подставим численные значения и произведём вычисления:

Изменение внутренней энергии в процессе 1 – 2 вычмсляется по формуле:
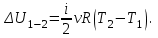
Применим уравнение Менделеева - Клапейрона для первого и второго состояний газа:
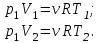
Где  - универсальная газовая постоянная, - универсальная газовая постоянная,  - степень свободы молекул двухатомного газа. - степень свободы молекул двухатомного газа.
Находим разность второго и первого уравнений:

После подстановки в формулу изменения внутренней энергии, получаем:
|
Найти:
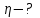
|
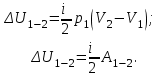
Вычисляем количество теплоты  , полученное газом в процессе 1-2, применяя первый закон термодинамики: , полученное газом в процессе 1-2, применяя первый закон термодинамики:
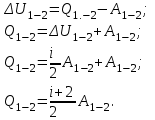
Подставим численные значения и произведём вычисления:

В адиабатном процессе  : :
Учитывая, что для изотермического процесса 3 – 1  , по первому закону термодинамики, получаем: , по первому закону термодинамики, получаем:

Работа газа при изотермическом процессе вычисляется по формуле:
 . .
Согласно уравнению Менделеева – Клапейрона для первого состояния газа, получаем:

После подстановки, получаем:

Найдём объём азота  для третьего состояния. для третьего состояния.
Для изобарного процесса 1 – 2  . .
Для изотермического процесса 3 – 1, имеем:

Для адиабатного процесса 2 – 3, получаем:
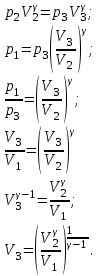
Где 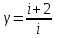 - показатель адиабаты. - показатель адиабаты.
Следовательно:
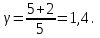
Подставим численные значения и произведём вычисления объём азота  для третьего состояния: для третьего состояния:

Подставим численные значения и произведём вычисления 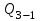 : :

Количество теплоты, полученное газом за цикл от нагревателя:

Количество теплоты, отданое газом за цикл холодильнику:

Теперь вычисляем КПД цикла:

Ответ: 
|
Задача 3.
Идеальный газ находится в однородном поле тяжести Земли. Молярная масса газа  . Абсолютная температура газа меняется с высотой h по закону . Абсолютная температура газа меняется с высотой h по закону  . Найти давление газа р на высоте . Найти давление газа р на высоте 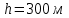 . На высоте . На высоте 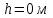 давление газа давление газа  . .
Дано:


𝑇0 = 250К

𝘩 = 100 м

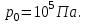
|
Решение:
Применим барометрическую формулу:

Где  - ускорение свободного падения, - ускорение свободного падения,  - универсальная газовая постоянная. - универсальная газовая постоянная.
Учитывая условие задачи, получаем:

Подставим численные значения и вычислим:
-
𝑝 = 105 * 𝑒 = 114568 Па
Ответ: 𝑝 = 114568 Па
|
Найти:

|
|
|
|
 Скачать 1.02 Mb.
Скачать 1.02 Mb. МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ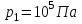 ,
,  30 л и
30 л и  ,
,  20 л. Найти давление, объём и температуру газа
20 л. Найти давление, объём и температуру газа  в промежуточном состоянии 2. Изобразить процессы в координатах P - V, P - T и V - T.
в промежуточном состоянии 2. Изобразить процессы в координатах P - V, P - T и V - T. совершает замкнутый цикл, состоящий из трех процессов: изобарного 1 - 2, адиабатного 2 - 3 и изотермического 3 - 1, идущий по часовой стрелке. Значения давления и объёма газа в состояниях 1, 2 и 3 равны соответственно
совершает замкнутый цикл, состоящий из трех процессов: изобарного 1 - 2, адиабатного 2 - 3 и изотермического 3 - 1, идущий по часовой стрелке. Значения давления и объёма газа в состояниях 1, 2 и 3 равны соответственно 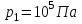 ,
,  , и
, и  . Найти термический к.п.д. цикла.
. Найти термический к.п.д. цикла. . Абсолютная температура газа меняется с высотой h по закону
. Абсолютная температура газа меняется с высотой h по закону  . Найти давление газа р на высоте
. Найти давление газа р на высоте 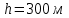 . На высоте
. На высоте 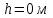 давление газа
давление газа  .
.


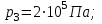


 - универсальная газовая постоянная.
- универсальная газовая постоянная. = 722К
= 722К
 = 361 К
= 361 К

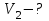

 = 481 К
= 481 К
 твет: Т2= 722 К, 𝑝2= 2*10⁵ Па, 𝑉2= 30*10-3м3
твет: Т2= 722 К, 𝑝2= 2*10⁵ Па, 𝑉2= 30*10-3м3

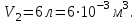
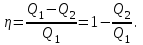
 - количество теплоты, переданное газу за цикл от нагревателя;
- количество теплоты, переданное газу за цикл от нагревателя;  - количество теплоты, отданое газом за цикл холодильнику.
- количество теплоты, отданое газом за цикл холодильнику.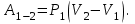

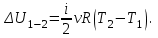
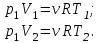
 - степень свободы молекул двухатомного газа.
- степень свободы молекул двухатомного газа.
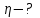
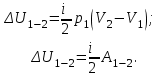
 , полученное газом в процессе 1-2, применяя первый закон термодинамики:
, полученное газом в процессе 1-2, применяя первый закон термодинамики: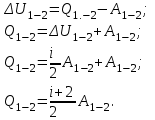

 :
: , по первому закону термодинамики, получаем:
, по первому закону термодинамики, получаем:
 .
.

 для третьего состояния.
для третьего состояния. .
.
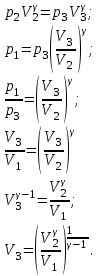
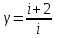 - показатель адиабаты.
- показатель адиабаты.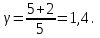

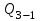 :
:








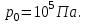

 - ускорение свободного падения,
- ускорение свободного падения, 

