Лабораторная работа ОВР. ОВР. Окислительновосстановительные реакции
 Скачать 19.33 Kb. Скачать 19.33 Kb.
|
|
Отчёт по лабораторной работе Тема: «Окислительно-восстановительные реакции» Цель: провести окислительно-восстановительную реакцию, составить уравнение и уравнять методом полуреакций. Ход работы: В пробирку наливаем 2 мл раствора манганата калия K2MnO4 и добавляем 2 мл раствора нитрита калия. Наблюдения и результаты: Наблюдаем образование осадка коричневого цвета диоксида марганца и изменение цвета раствора. Составим уравнение и ионно-электронный баланс: 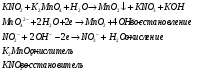 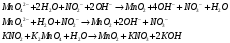 Вывод: Таким образом, в нейтральной среде манганат-ион MnO42- восстанавливается до осадка MnO2, а нитрит-ион NO2- окисляется до нитрат-иона NO3-. Ответы на контрольные вопросы: Окисление и восстановление — взаимосвязанные процессы, которые всегда протекают одновременно. Когда одно вещество окисляется, то другое восстанавливается, и наоборот. Окислитель – нейтральная молекула, ион или частица в процессе восстановления получает электроны и окисляющий атом понижает свою степень окисления. В процессе окисления восстанавливающий атом отдает электроны, тем самым повышая свою степень окисления. Степень окисления восстановителя повышается, степень окисления окислителя понижается. Наиболее окислительные свойства проявляют элементы с высоким значением электроотрицательности – фтор, кислотород, хлор, сера и другие. Наиболее восстановительные свойства проявляют щелочные металлы – элементы первой группы главной подруппы – натрий, цезий, калий, литий и другие. Окислительно-воостановительные свойства изменяются в периоде и группе и зависят от радиуса атома и заряда ядра следующим образом: - окислительные свойства увеличиваются в периоде слева направо, соответственно, восстановительные уменьшаются. - окислительные свойства в группе сверху вниз уменьшаются, восстановительные свойства наоборот увеличиваются. |
