Лабораторная работа 4.4.1. Определение концентрации фосфатов в почве фотоколориметрическим способом
 Скачать 35.12 Kb. Скачать 35.12 Kb.
|
|
Лабораторная работа «Определение концентрации фосфатов в почве фотоколориметрическим способом» Цель работы: ознакомление с методом фотоколориметрии на примере определения фосфатов в почве. Ход работы. 1.1. Построение градуировочного графика. 1. Для построения градуировочного графика готовят серию стандартных растворов фосфора (V). Для этого в семь пронумерованных мерных колб на 50 мл последовательно вносят пипеткой аликвоты стандартного раствора фосфора 0,2; 0,4; 0,6; 0,8; 1,0; 1,2; 1,4 мл. 2. Затем в каждую колбу приливают по 5 мл растворов ванадата аммония, молибдата аммония и азотной кислоты. Объём жидкости в колбах доводят до метки дистиллированной водой, перемешивают и оставляют на 30 минут для завершения реакции (для развития окраски). 3. Далее измеряют оптическую плотность (светопоглощение) D полученных окрашенных растворов на фотоколориметре при длине волны λ = 440 нм в кювете толщиной 10 мм. В качестве раствора сравнения (холостой пробы) используют дистиллированную воду, в которую добавлены все те же реагенты (см. п.2) для которой D = 0. 4. Результаты измерений заносят в таблицу:
5. Концентрацию фотометрируемого раствора С, мг Р/мл, рассчитывают по уравнению: 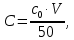 где, С0 – концентрация фосфора в стандартном растворе, мгР/мл; V– объём аликвоты, мл; 50 – объём мерной колбы, мл. 6. Строят градуировочный график в координатах D = f(С). 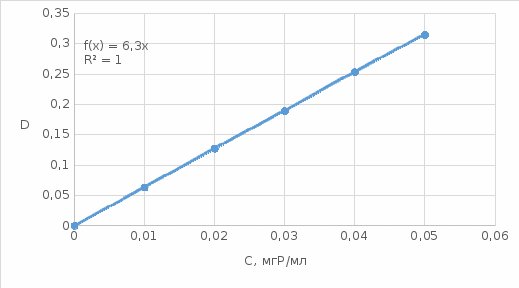 1.2. Определение содержания фосфатов в почве 1. В коническую колбу на 250 мл помещают 20 г воздушно-сухой почвы и приливают 50 мл 10 %-ной уксусной кислоты (или 0,1 н HCl), перемешивают в течении 2-3 минут и оставляют на 30 минут (вытяжка из почвы). 2. Почву отфильтровывают, используя складчатый фильтр. 3. В две мерные колбы на 50 мл вносят пипеткой по 5 мл полученного фильтрата. В каждую колбу вносят по 5 мл растворов ванадата аммония, молибдата аммония и азотной кислоты. Доводят объём жидкости в колбах до метки дистиллированной водой, перемешивают и оставляют на 30 мин. 4. Измеряют оптическую плотность исследуемых растворов (D1 и D2) аналогично п.3 построения градуировочного графика. Измерение оптической плотности исследуемых растворов проводят не менее трёх раз. Рассчитывают среднее значение Dх для каждого раствора. 5. Результаты измерений исследуемых растворов заносят в таблицу:
6. С помощью построенного калибровочного графика находят значения Сх для каждого исследуемого раствора (С1 и С2) по средним значениям Dх. 7. Для нахождения среднего значения Сср используют формулу: 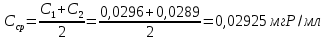 8. Содержание фосфора в почве (Х мг Р на 100г почвы) рассчитывают по формуле: 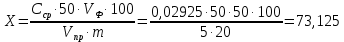 где 50 – объём мерной колбы, мл; Vпр. – объём пробы фильтрата, взятый для анализа, мл; Vф. – объём раствора кислоты, взятый для экстракции фосфатов из почвы, мл; m – масса почвы, г. 9. По полученным результатам делают вывод о содержании фосфора в почве (ссылаясь на нормы содержания). Нормальное количество фосфатов в почвах нечернозёмной зоны изменяется от 3 до 30 мг на 100г почвы. Содержание фосфора в анализируемой почве составило 73,125 мг на 100 г почвы, это выше нормы. ОТВЕТЫ НА ВОПРОСЫ: В чем состоит сущность фотометрического анализа? Способность веществ избирательно поглощать ультрафиолетовое, видимое или инфракрасное излучение лежит в основе фотометрического метода количественного анализа. Сформулируйте основной закон светопоглощения и приведите его математическое выражение. Закон Бугера – Ламберта – Бера: оптическая плотность раствора прямопропорцианальна концентрации светопоглощающего вещества, толщине слоя раствора и молярному коэффициенту светопоглощения: 𝐼=𝐼0⋅10−𝜀𝜆⋅𝐶⋅𝑙 где: I0 - интенсивность падающего потока света; l – толщина поглощающего слоя, см; С – концентрация поглощающего вещества, моль/л; ε – молярный коэффициент светопоглощения при данной длине волны λ Как в фотоколориметрах получают монохроматические световые потоки? В фотоколориметрах нужные спектральные диапазоны выделяются при помощи светофильтров, ограничивающих участки спектра, в которых могут проводится измерения. Как влияет толщина слоя поглощающего раствора на его оптическую плотность? Оптическая плотность прямо пропорциональна толщине слоя поглощающего раствора. Что называют градуировочным графиком? Каким образом, и с какой целью его строят? Градуировочный график – график зависимости D = f(С). Готовят серию стандартных (или эталонных) растворов анализируемого вещества с различными, но точно заданными заранее концентрациями. После выполнения с этими растворами выбранной аналитической реакции измеряют оптическую плотность полученных окрашенных растворов при определенной длине волны и толщине слоя относительно растворителя или раствора сравнения, который содержит все те же реагенты, что и рабочие растворы, кроме определяемого вещества. Строят график зависимости D = f(С). Градуировочный график строят для анализа раствора с неизвестным содержанием определяемого вещества. С помощью графика находят концентрацию вещества С𝑋. Какие основные пути поступления и эвакуации фосфора в почвенном покрове? В чем заключается негативный эффект повышенного содержания фосфора в почве? В основном происходит одностороннее движение фосфора с суши в воду и далее в донные отложения в форме гидро- и дигидроанионов HPO42– и H2PO4– с катионами меди, железа и других тяжелых металлов. Главным антропогенным источником фосфатов являются фосфорные удобрения: СaHPO4; Сa(H2PO4)2; NH4H2PO4 и (NH4)2HPO4. Поступление фосфатов из почвы в водоёмы с грунтовыми водами и поверхностными стоками является одним из факторов ускоренного эвтрофирования водоёмов. Избыточное накопление фосфатов в почве приводит к загрязнению грунтовых вод и природных водоёмов. Приведите еще несколько примеров использования фотометрического анализа для контроля параметров окружающей среды. Фотометрический анализ имеет большое значение в аналитическом контроле загрязнений окружающей среды и решение экологических проблем вредных производств. Например, для определения мутности, цветности природной воды, содержания ионов тяжелых металлов в воде, содержания ионов тяжелых металлов в сварочных аэрозолях и т.п. 9. При фотоколориметрическом определении Cr3+ из стандартного раствора приготовили серию растворов в мерных колбах вместимостью 100 см3, измерили оптическую плотность и получили следующие данные:
Определите концентрацию Cr3+ в анализируемых растворах, если их оптическое поглощение равно 0,300 и 0,100. Строим градуировочный график: 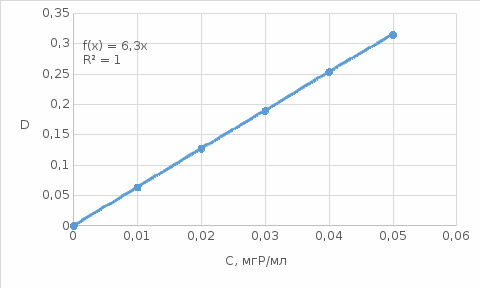 По уравнению прямой рассчитываем концентрацию анализируемых растворов: С1 = 0,300/6,3018 = 0,0476 мг/мл; С2 = 0,100/6,3018 = 0,0159 мг/мл; |
