Определения дифференциальной теплоты растворения. Laboratornaya_rabota Определения дифференциальной теплоты раство. Определения дифференциальной теплоты растворения Цель
 Скачать 35 Kb. Скачать 35 Kb.
|
|
Определения дифференциальной теплоты растворения Цель: Определить дифференциальную теплоту растворения из температурной зависимости электропроводности. Реактивы : 1) KCL 0,02 н раствор; 2) H2O; 3) CaSO4 Оборудование : 1) Сосуд для измерения электропроводности; 2) прибор для измерения электропроводности; 3) электроды; 4) термометр; 4) термостат Ход работы: Для нахождения растворимости труднорастворимых электролитов воспользуемся определением электропроводности растворов. Удельной электропроводностью раствора (æ)называется электропроводность 1 куб. см. раствора , помещенного между параллельными электродами площадью 1 кв. см. при расстоянии между ними 1см. Если рассматривается объем раствора , который содержит эквивалент электролита , то его электропроводность называется эквивалентной и связана с удельной соотношением λ = æ*1000/с где с – концентрация раствора в экв/л. Поскольку рассматриваются раствор труднорастворимых соединений, то они по своему поведению приближаются к бесконечно разбавленным растворам электролитов , для которых по закону Кольрауша эквивалентная электропроводность электролитов равна сумме подвижностей катиона и аниона ( эти величины могут быть взяты со справочника). Тогда: С = æ*1000/ λ∞ = æ*1000/( λа + λк) Определим постоянную электролитического сосуда, воспользовавшись стандартным раствором KCl(0,02н). К = æ KCl* RKCl æ KCl = 25.53*10-4 Ом-1*см-1 RKCl = 177 Ом Следовательно К = æ KCl* RKCl = 25,53*10-4 * 177 = 0,452 см-1 æ H2O =2*10-6 Oм-1 см-1 Далее определяем растворимость соли СaSO4 , для чего помещаем колбу с раствором и осадком труднорастворимой соли в термостат , и определяем электропроводность раствора при различных температурах. Затем рассчитываем растворимость соли по уравнению С = (æр-ра – æ H2O) * 1000 / ( λа + λк) , г-экв/л Таблица результатов
Далее рассчитываем дифференциальную теплоту растворения, построив график зависимости D = ln C / (1/T) и определяем тангенс угла на прямой к оси 1/Т. 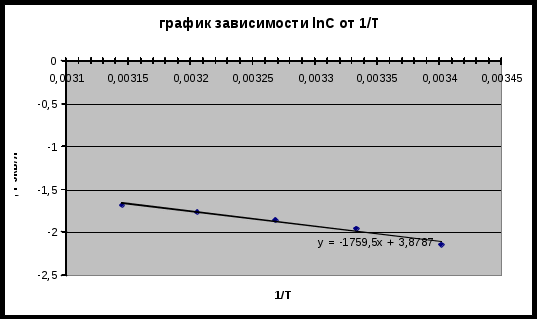 Отсюда tgα = -1759.5 ΔHp = -Rtgα = 14.63кДж/моль Вывод: В ходе работы была определена дифференциальная теплота растворения исследоваемой соли - СaSO4 — из температурной зависимости электропроводности. |
