промежутка. Орловская обасть управление образования администрации г. Орла муниципальное бюджетное общеобразовательное учреждение
 Скачать 371.45 Kb. Скачать 371.45 Kb.
|
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ ОРЛОВСКАЯ ОБАСТЬ УПРАВЛЕНИЕ ОБРАЗОВАНИЯ АДМИНИСТРАЦИИ Г. ОРЛА МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ- ШКОЛА № 51 ГОРОДА ОРЛА 302005, г. Орёл, ул. Полковника Старинова, д.2 sc51orel@yandex.ru , тел. 79-44-51
ПРОМЕЖУТОЧНАЯ АТТЕСТАЦИЯ ЗА 1 ПОЛУГОДИЕ ПО ХИМИИ Работа, выполняемая в рамках промежуточной аттестации по химии, составлена в формате Основного государственного экзамена по химии в 9 классе со включением заданий базового уровня. За задание 1- 17 – 1 б. За задание 18 максимально 3б. Оценка «5» ставится, если учащийся набрал 17-18 балла; Оценка «4» ставится, если учащийся набрал 15-16 баллов; Оценка «3» ставится, если учащийся набрал 13-14 баллов; В случае если учащийся набрал менее 14 баллов, он получает оценку «2». Время выполнения работы – 50 минут Вариант 1 №1. Выберите два высказывания, в которых говорится о барии как о химическом элементе. 1) В земной коре содержится 0,05 % бария. 2) Барий плавится при температуре 710 °C. 3) Зелёная окраска пламени — «визитная карточка» бария, даже если он присутствует в микроскопических количествах. 4) Барий используют в качестве геттера — поглотителя остатков газов в вакуумных приборах. 5) Барий самовоспламеняется от удара, легко разлагает воду. №2. Выберите два высказывания, в которых говорится о фторе как о простом веществе. 1) Кремний и древесный уголь самовоспламеняются во фторе. 2) В состав зубной эмали входит до 0,02 % фтора. 3) Фтор ядовит. 4) Во фреонах фтор работает на «индустрию холода». 5) Пластмассы, содержащие фтор, характеризуются химической и термической устойчивостью. №3. На приведённом рисунке изображена модель атома химического элемента. Запишите в таблицу величину заряда ядра (Х) атома химического элемента, модель которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе. (Для записи ответа используйте арабские цифры.)  №4. Запишите в поле ответа число электронов в основном состоянии и количество электронных оболочек химического элемента, ядро которого содержит 5 протонов. №5. Расположите химические элементы – 1) стронций 2) барий 3) кальций в порядке увеличения числа заполненных энергетических уровней. Запишите номера выбранных элементов в соответствующем порядке. №6. Расположите химические элементы – 1) кальций 2) алюминий 3) сера в порядке изменения от кислотных к основным свойств их высших оксидов. Запишите номера выбранных элементов в соответствующем порядке. №7  №8  №9 Из предложенного перечня выберите две пары веществ, для одного из которых характерна ковалентная неполярная, а для другого — ионной связью: 1) оксид фосфора и оксид натрия 2) хлорид натрия и аммиак 3) азот и сульфид натрия 4) бром и оксид магния 5) хлорид кальция и хлороводород №10Из предложенного перечня выберите два вещества, для которых характерна ковалентная неполярная связь: 1) молекула хлороводорода 2) кристалл SiO2 3) кристалл кремния 4) молекула пероксида водорода 5) молекула воды №11Какие два утверждения верны для характеристики как азота, так и кислорода? 1) Атом химического элемента имеет 5 валентных электронов 2) Низшая степень окисления химического элемента равна -3 3) Соответствующее простое вещество при н. у. является газом 4) Число протонов в ядре атома химического элемента равно 7 5) Электроотрицательность химического элемента выше, чем у углерода №12 Из предложенного перечня выберите вещества формулы оснований и кислотного оксида BaCl2 2) Mg(OH)2 3)P2O5 4)NO 5)Al(OH)3 №13 Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
№14 Вычислите в процентах массовую долю углерода в карбонате кальция. Запишите число с точностью до целых. Карбонат кальция — химическое соединение CaCO3 в медицине используется в качестве лекарственного средства при болезнях костных тканей. №15 Для подкормки растений в почву вносят 4 г фосфора на один квадратный метр. Какую массу (в граммах) фосфата натрия нужно взять для подкормки 100 м2 почвы? Запишите число с точностью до целых. Фосфат натрия — химическое соединение Na3PO4 соль ортофосфорной кислоты, используется в качестве фосфатного удобрения. . №16 Используя метод электронного баланса, составьте уравнение реакции H2S + Cl2 + H2O → H2SO4 + HCl Определите окислитель и восстановитель. Вариант 2 №1. Выберите два высказывания, в которых говорится о натрии как о химическом элементе. 1) Натрий хорошо проводит тепло. 2) Известны шесть радиоактивных изотопов натрия. 3) Натрий входит в состав галита. 4) С помощью амальгамы натрия можно определить содержание влаги в пробе органического вещества. 5) При окислении натрия в сухом воздухе образуется перекись. №2. Выберите два высказывания, в которых говорится о кремнии как о простом веществе. 1) Массовая доля кремния в земной коре превышает 25 %. 2) Кремний обладает полупроводниковыми свойствами. 3) Кремний не растворяется в воде. 4) Кремний входит в состав слюды и полевого шпата. 5) При переломах костей содержание кремния в месте перелома возрастает почти в 50 раз. №3 На приведённом рисунке изображена модель атома химического элемента. Запишите в поле ответа номер периода и номер группы, в которых расположен химический элемент, модель которого изображена на рисунке. (Для записи ответа используйте арабские цифры.) 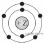 №4. Запишите в поле ответа число электронов в основном состоянии и количество электронных оболочек химического элемента, ядро которого содержит 3 протона. №5Расположите химические элементы – 1) сера 2) фосфор 3) кремний в порядке ослабления восстановительных свойств. Запишите номера выбранных элементов в соответствующем порядке. №6Расположите химические элементы – 1) литий 2) азот 3) углерод в порядке уменьшения электроотрицательности. Запишите номера выбранных элементов в соответствующем порядке. №7  №8  №9Из предложенного перечня выберите два вещества, для которых характерна ковалентная полярная связь: 1) серная кислота 2) пластическая сера 3) хлор 4) аммиак 5) сульфид рубидия №10Из предложенного перечня выберите два вещества, для которых характерна ионная связь: 1) оксид серы(IV) 2) оксид бария 3) сероводород 4) аммиак 5) сульфид бария №11Какие два утверждения верны для характеристики как фосфора, так и кремния? 1) Имеет 4 валентных электрона 2) Электроны в атоме расположены на трёх электронных слоях 3) Химический элемент образует высший оксид вида XO2 4) Является p-элементом 5) Число протонов в ядре атома химического элемента равно 14. №12 Из предложенного перечня выберите вещества формулы амфотерного оксида и основания Fe(OH)2 2)Mg(NO3)2 3)CaO 4)Al2O3 5)FeS №13 Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
№14Вычислите в процентах массовую долю кислорода в карбонате лития. Запишите число с точностью до целых. Карбонат лития — химическое соединение Li2CO3 в медицине применяется для профилактики и лечения аффективных расстройств. №15 для подкормки растений в почву вносят 5 г азота на один квадратный метр. Какую массу (в граммах) калийной селитры нужно взять для подкормки 150 м2 почвы? Запишите число с точностью до целых. Нитрат калия (калийная селитра) — химическое соединение KNO3 используется в качестве ценного удобрения. №16 Используя метод электронного баланса, составьте уравнение реакции NaMnO4 + NaOH → Na2MnO4 + O2 + H2O Определите окислитель и восстановитель. Ответы на задания Вариант 1
№16 Используя метод электронного баланса, составьте уравнение реакции H2S + Cl2 + H2O → H2SO4 + HCl Определите окислитель и восстановитель.
Вариант 2
№16. Используя метод электронного баланса, составьте уравнение реакции NaMnO4 + NaOH → Na2MnO4 + O2 + H2O Определите окислитель и восстановитель.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
