Термодинамика. химия 6. Ошауланан жйе тек ана энергиямен алмасатын жабы жйе
 Скачать 70.31 Kb. Скачать 70.31 Kb.
|
|
«Қазақстан Республикасы Ғылым және Білім Министрлігі,Қазақ Ұлттық қыздыр педагогикалық университеті,Жаратылыстану институты Химия кафедрасы»  Тақырып: «Химиялық термодинамика» Тексерген:Камысбаева Алия Кенесбековна Орындаған:6В05301-Химия мамандығының 1-курс студенті Әмірбек Гүлназ 2021ж. Химиялық термодинамика Табиғаттағы барлық үрдістер қоршаған ортада энергетикалық өзгеруімен жүреді, сондықтан жүйе қасиетін алдын-ала айту үшін оның энергетикалық күйін білу кажет. Энергиялардың әр алуан түрлерінің өзара ауысуын, энергетикалық баланстарды және химиялық тепе-теңдікті зерттейтін химияның бөлімін химиялық термодинамика деп атайды. Химиялық термодинамиканың көмегімен: кез-келген физика-химиялық үрдістің жылулық эффектісінің сандық мәнін;өздігінен журетін үрдістің шегі мен мүмкіндігін;химиялық тепе-теңдіктің ығысу шарттарын есептеуге мүмкіндік береді. Термодинамика жеке микробелшектердің қозғалыстарын қарастырмайды, өте көп микробөлшектерден тұратын макрообъектінің физикалык касиеттерін және процестің температураға, кысымға, электр немесе магнит өрісіне және т.б. параметрлерге жалпы тәуелділігін қарастырады. Термодинамикалық жүйе - зерттеу нысаны ретінде физикалық денелердің коршаған ортадан нақты немесе ойша түрде бөлініп алынған жиынтығы. Мысалы: сыйымдылықтағы сұйықтық, баллондағы газ және т.б. Қоршаған ортамен байланысу сипатының тәуелділігіне қарай термодинамикалық жүйелер бөлінеді: • массамен де, энергиямен де алмаспайтын оқшауланған жүйе; • тек қана энергиямен алмасатын жабық жүйе; • массамен де, энергиямен де алмасатын ашық жүйе. Жүйенің күйін анықтайтын өзгермелі өлшемдер күйлердің термодинамикалық шамалары деп аталады. Термодинамикалық жүйенің күйін сипаттайтын физикалық шамалар: масса (m), зат мөлшері (n), температура (T), қысым (p), көлем (V), концентрация (C), тығыздық ( ρ ), молярлық электрөткізгіштік ( λ ), ішкі энергия (U), энтальпия (H), энтропия (S), және т.б. Егер бұл шамалар белгілі бір уақытта өзгермесе, олар термодинамикалық тепе-теңдік күйін құрайды: • изотермиялық (Т = const) • адиабаталық (Q = const) • изобаралық (Р = const) • изобара-изотермиялық (P=const,T= const) • изохоралық (V= const) • изохора-изотермиялық (V=const,T= const) Жүйенің энергетикалық күйін келесі термодинамикалық функциялар көмегімен есептеуге болады: • ішкі энергия (U) • энтропия (S) • жұмыс (A) • Гиббс энергиясы (G) • жылу (Q) • Гельмгольц энергиясы (F) • энтальпия (Н) • химиялық потенциал ( m ) Ішкі энергия Кез келген реакцияның жүретінін немесе жүрмейтінін алдын ала білу-химиктердің алдында тұрған басты міндеттердің бірі. Мысалы: 1.Әктасты өртеу: CaCO3=CaO+CO2. Бұл процесс жүзеге асу үшін әктасты жоғары температурада қыздыру керек.Демек,реакция жоғары температурада жүреді. 2.Су құрамынан сутекті мыстың көмегімен тотықсыздандыру: Cu+H2O 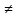 Бұл реакция ешқандай жағдайда жүзеге асыру мүмкін емес! Бұл реакция ешқандай жағдайда жүзеге асыру мүмкін емес!Реакцияның жүру мүмкіндігін эксперимент арқылы тексеру,әрине,қиын әрі тиімді емес.Бұл реакцияның жүрмейтінін теориялық тұрғыдан термодинамиканың заңдары дәлелдейді. Термодинамиканың бірінші заңы-энергияның сақталу заңы:энергия жоқтан пайда болмайды және жоғалып та кетпейді,тек бір түрден екінші түрге ауысады. Жалпы алғанда,кез келген дененің энергиясы:кинетикалық, потенциялдық, ішкі энергиядеп бөлінетін негізгі үш түрінен құралады.Химиялық реакция үшін ең маңыздысы ішкі энергия. Әр жүйенің ішкі энергиясы (U) болады.Ол-жүйе энергиясының жалпы қоры.Оған жүйеге кіретін барлық молекулалар,атомдар,электрондар қозғалысының энергиясы,молекулааралық байланыс энергиясы және бөлшектердің кеңістіктегі орнына байланысты кинетикалық және потенциалдық энергиялары кіреді. Ішкі энергияның абсолют мәнін табу мүмкін емес.Тек оның біркүйден екінші күйге ауысқандағы өзгерісін ғана анықтауға болады.Егер бастапқы күйдегі ішкі энергия U1ал соңғы күйде U2 болса,оның өзгерісі: U=U2-U1. Яғни, U жүйенің соңғы және бастапқы күйіне тәуелді. Заттың ішкі энергиясы U-сол затты құрайтын барлық бөлшектердің энергиясы,ол кинетикалық және потенциалдық энергиядан тұрады: U= 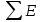 k + k +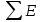 n. n.Ішкі энергия,сонымен қатар электрондардың,протондардың нейтрондардың қозғалысы мен өзара әрекеттесу энергиясы. Ішкі энергия-дененің жылулық күйінің сипаттамасы.Жүйенің ішкі энергиясының өзгерісін  U анықтауға болады.Мысалы,бір процесс нәтижесінде жүйе A жұмысын жасап,сыртқы ортадан Q энергия сіңіріп, сөйтіп, бастапқы күйден(1)соңғы күйге(2) ауысады.Термохимиялық теңдеулерде жүйеден бөлінген энергия оң саналса,ал термодинамиканың теңдеулерінде жүйенің сіңірген жылуы оң саналады.Жүйенің ішкі энергиясының өзгерісі: U анықтауға болады.Мысалы,бір процесс нәтижесінде жүйе A жұмысын жасап,сыртқы ортадан Q энергия сіңіріп, сөйтіп, бастапқы күйден(1)соңғы күйге(2) ауысады.Термохимиялық теңдеулерде жүйеден бөлінген энергия оң саналса,ал термодинамиканың теңдеулерінде жүйенің сіңірген жылуы оң саналады.Жүйенің ішкі энергиясының өзгерісі:(1) U2=U1+Q-A (2)  U =Q-A U =Q-AЭнтальпия Химиялық реакция жүрген кезде бастапқы заттардағы байланыстар үзіліп,реакция өнімінде жаңа байланыстар түзіледі.Байланыстар үзілгенде энергия қабылдап,ал жаңа байланыс түзілгенде энергия бөліп жүреді.Сондықтан, химиялық ревкция кезінде энергиялық эффект бөлінеді.Энергия жылу түрінде бөлінеді және қабылданады.Жылу бөліну және қабылдау бойынша реакциялар:эндотермиялық және экзотермиялық болып бөлінеді. Жылу бөліне жүретін реакциялар-экзотермиялық; Жылу кабылдай жүретін реакциялар-эндотермиялы. 1.Мысалы,сутек пен хлордың әрекеттесу реакциясы жылу бөле жүреді,яғни экзотермиялық реакция: H2+Cl2=2HCl;  H= -184,6кДж. Мұнда сутек пен хлор молекулаларының ыдырауына қажет энергия,екі HCl түзілуіне қажет энергиядан кем. H= -184,6кДж. Мұнда сутек пен хлор молекулаларының ыдырауына қажет энергия,екі HCl түзілуіне қажет энергиядан кем.2.Эндотермиялық реакцияға мысал ретінде азоттың тотығуын қарастырдым: N2+O2=2NO;  H=180,8кДж. Бұл жағдайда азот пен оттек молекулаларын ыдыратуға қажет энергия,екі NO түзілуден бөлінетін энергиядан көп. H=180,8кДж. Бұл жағдайда азот пен оттек молекулаларын ыдыратуға қажет энергия,екі NO түзілуден бөлінетін энергиядан көп.Химиялық реакция кезінде бөлінетін немесе қабылданатын жылу мөлшері реакцияның жылу эффектісі деп аталады. Химиялық реакцияның жылу эффектісін зерттейтін термодинамика бөлімін-термохимия деп атайды. Заттар үшін жылу бөлетін немесе жылу сіңіретін қабілеттерін сипаттайтын шамалар керек.Процесті жүргізу жағдайына байланысты 2 шама енгізілген.Тұрақты көлемде жүретін реакцияны ішкі энергиямен(U),ал тұрақты қысымда жүретін реакцияны-энтальпиямен(H)сипаттайды. Энтальпия-тұрақты қысымда жылуға айналдыруға болатын энергия. Жүйенің энтальпиясы термодинамикалық жүйенің күйін сипаттайтын энтропия(S),қысым (p)және энергиямен (U)байланысты: Н= U + рV Гесс заңы Барлық қосылыстарды жай заттарды реакторда араластырып ала беруге болмайды. Мысалы,глюкозаны C6H12O6 тікелей көміртекті,оттекті және сутекті әрекеттестіріп алуға болмайды.Ол-тірі жасушадағы биохимиялық процестердің нәтижесінде түзілетін зат. Мұндай жағдайда Гесс заңының көмегіне жүгінеміз,химиялық реакцияның жылу эффектісі оның жүру жолына тәуелсіз,өнім мен реагеттердің энергетикалық күйлерінің айырмасымен анықталады. Мысалы,көмірқышқыл газын көміртек пен оттектен екі жолмен алуға болады: 1) көміртекті оттектің артық мөлшерінде жағу арқылы бір сатыда алу:C+O2=CO2, оның жылу эффектісі- 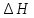 2) алдымен көміртек монооксидін алып,одан кейін оны өртеп,яғни екі сатыда алу: C+1/2 O2=CO, 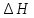 1 1C+1/2O2=CO, 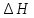 2 2Гесс заңына сүйене отырып қысым(P)және температура(t)өзгермесе: H= 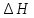 1+ 1+ 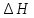 2 2CO-ның түзілу жылу эффектісін( 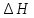 1)тәжірибеден таба алмаймыз,ал формула бойынша оңай есептейміз: 1)тәжірибеден таба алмаймыз,ал формула бойынша оңай есептейміз: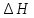 1= H 1= H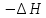 2 2Мысалы: ацетиленнің түзілу энтальпиясын табу керек, егер оның жану жылуы  H=-1299,613 кДж болса; H=-1299,613 кДж болса;C2H2(г)+ 2,5 O2(г) = 2CO2(г) + H2O(с)  H=-1299,613 кДж H=-1299,613 кДж H0түз.CO2 =-393,5 кДж H0түз.CO2 =-393,5 кДж H0түз.H2O =-285,8 кДж H0түз.H2O =-285,8 кДж H0түз.C2H2=? H0түз.C2H2=?Шешуі:  H=-1299,613= 2 H=-1299,613= 2 H0түз.CO2 + H0түз.CO2 + H0түз.H2O - H0түз.H2O -  H0түз.C2H2 =787+(-285,8)-H0 түз C2H2 H0түз.C2H2 =787+(-285,8)-H0 түз C2H2 Жауабы:  H0 түз C2H2= 226,8 кДж. H0 түз C2H2= 226,8 кДж.Гесс заңынан үш маңызды салдар шығады. 1-салдар.Реакцияның энтальпиясы өнім мен реагенттердің түзілу энтальпияларының айырмасына тең:  Hp= Hp=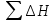 f (өнім)- f (өнім)-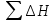 f(реаг.) f(реаг.)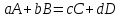  Hp=c Hp=c H f (C)+d H f (C)+d H f(D)-a H f(D)-a H f(A)-b H f(A)-b H f(B) H f(B)2-салдар.Реакцияның энтальпиясы реагенттер мен өнімнің жану энтальпияларының айырмасына тең:  Hp= Hp=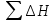 f (реаг.)- f (реаг.)-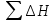 f (өнім) f (өнім) 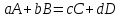  Hp=a Hp=a Hреаг(A)+b Hреаг(A)+b Hреаг(B)-c Hреаг(B)-c Hөнім(C)-d Hөнім(C)-d Hөнім(D) Hөнім(D)3-салдар.Реакцияның термохимиялық теңдеуін қосуға,азайтуға,көбейтуге және бөлуге болады,реакция қайтымды болса да,теңдеуді оңнан солға қарай жазуға болады. Энтропия Термодинамиканың екінші заңы-өздігінен жүретін процестердің жүру мүмкдігі туралы заң.Термодинамиканың екінші заңы негізінде процестің кандай жағдайларда жүруі мүмкін бола алатынын және оның кай бағытта жүретіндігін болжауға болады.Әртурлі процестердің жүру мүмкіндігі туралы мәселе тек теорияда ғана емес,практикада да маңызды. Егер химиялық және физика-химиялық процестерді термодинамиканың бірінші заңы тұрғысынан зерттегенде iшкi энергия ұғымы кеңінен колданылса, оларды термодинамиканың екінші заңы негізінде зерттегенде жаңа функция - энтропияны енгізу кажеттілігі туындады. Энтропия(S)-жүйенің ретсіздігін сипаттайтын термодинамикалық функция. 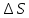 өзгерісі тепе-теңдік процесінде жүйеге берілетін немесе одан сыртқы шығатын жылу мөлшерінің абсолюттік температураға қатынасына тең. өзгерісі тепе-теңдік процесінде жүйеге берілетін немесе одан сыртқы шығатын жылу мөлшерінің абсолюттік температураға қатынасына тең.Энтропия ұғымын алғаш рет 1865ж. Неміс ғалымы Клаузиус енгізді.Ол энтропия өзгерісін қайтымды процестер үшін жалпы жылу мөлшері өзгерісінің  Q абсолюттік температураға қатынасымен өрнектеді: Q абсолюттік температураға қатынасымен өрнектеді: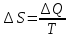 Бұл теңдік энтропияны емес,оның өзгерісін сипаттайды.Ол изотермиялық процестерге (T=const)қолданылады.Мысалы,балқу энтропиясының өзгерісі балқу жылуына тең: 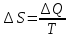 Қайтымды процестер үшін: 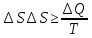 Л.Больцман энтропияны жүйенің термодинамикалық ықтималдығы W ретінде анықтады.Жүйедегі бөлшектердің саны көп болғандықтан NA=6,02 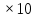 23, энтропия жүйенің термодинамикалық ықтималдық күйінің ондық логарифміне пропорционал болады: 23, энтропия жүйенің термодинамикалық ықтималдық күйінің ондық логарифміне пропорционал болады:S=klgW Химиялық реакция үшін энтропияның өзгерісі энтальпия өзгерісіне ұқсас: 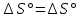 өнім өнім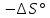 баст. баст.Идеалды дұрыс құрылымды кристалдың энтропиясы ең төменгі мәнге ие, яғни 0-ге тең.Мысалы егер қант кесегі стақандағы шайдың ішінде болса,оның энтропиялық күйі аз,егер еріп барлық көлемге таралса,энтропиясы жоғары болады. Термодинамиканың екінші заңы бойынша жабық жүйедегі өздігінен жүретін процестер( 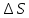  0)міндетті түрде жүйедегі барлық энтропияның өсуімен жүзеге асады.Температура жоғарылағанда молекулалар мен атомдар емін-еркін қозғала бастайды,яғни заттардың энтропиясы артады. Энторпияның өсуі температура көтерілгенде,кристалды заттар сұйыққа,әсіресе сұйықтан газға айналғанда қатты байқалады.Мысалға судың үш күйінің өзгерісін келтіруге болады. 0)міндетті түрде жүйедегі барлық энтропияның өсуімен жүзеге асады.Температура жоғарылағанда молекулалар мен атомдар емін-еркін қозғала бастайды,яғни заттардың энтропиясы артады. Энторпияның өсуі температура көтерілгенде,кристалды заттар сұйыққа,әсіресе сұйықтан газға айналғанда қатты байқалады.Мысалға судың үш күйінің өзгерісін келтіруге болады.Термодинамиканың үшінші заңы - температурасы абсолютті нөлге жуық, сұйытылған жүйеде өтетін реакциялар үшін максимал пайдалы жұмыс пен жылу эффектісінің қисықтары бірігеді және температураның жалпы жанама, параллель осътеріне ие болады. Термодинамиканың үшінші заңы барлық таза заттардың абсолюттік энтропиясын кез келген температурада анықтауға мүмкіндік береді. Заттардың энтропияларының мәндерін салыстыру үшін оларды стандартты жағдайда қарастырады: Т = 298К, Р = 101325 Па, ерітінділер үшін концентрациясы немесе активтілігі 1-ге тең. Осы жағдайда аныкталган энтропияны S°298 деп белгілеп стандартты энтропия деп атайды. Жай заттардың стандартты энтропиясы нөлге тең емес.Басқа термодинамикалық функциялардан ерекшелігі абсолютті нөлде-кристалдық дененің энтропиясының мәні нөлге тең(Планк постулаты),себебі W=1. Заттардың немесе денелер жүйесінің энтропиясы белгілі температурада абсолютті шамаға ие.Мысалы:
Гиббстің еркін энергиясы Барлық хиялық реакциялар энтропия мен энтальпияның міндетті түрде өзгеруімен жүреді. Жүйенің энтальпиясы мен энтропиясы арасындағы байланысты Гиббстің еркін энергиясы немесе изобаралық-изотермиялық потенциал деп аталатын термодинамикалық күй функциясы орнатады. Гиббстің еркін энергиясы(G)-бұл максимал жұмысты орындау үшін қолданылатын жүйенің жалпы энергиясының бір бөлігі.Гиббстің еркін энергиясының жүйенің энтальпия және энтропиясымен байланысы : G = H  TS TS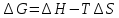 Жай заттар үшін Гиббс энергиясы нөлге тең. 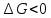 болса,процесс өздігінен жүреді немесе процесс термодинамикалық мүмкін деп есептеледі. болса,процесс өздігінен жүреді немесе процесс термодинамикалық мүмкін деп есептеледі.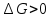 болса,реакция өздігінен жүрмейді немесе процесс термодинамикалық тұрғыдан мүмкін емес. болса,реакция өздігінен жүрмейді немесе процесс термодинамикалық тұрғыдан мүмкін емес.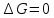 болса, онда реакция тура және кері бағытта жүре алады,реакция қайтымды. болса, онда реакция тура және кері бағытта жүре алады,реакция қайтымды.Демек,p=const болғанда,өздігінен жүзеге асатын реакцияларда Гиббстің еркін энергиясы азаяды. Процестің жүру барысында заттардың түзілу энтальпиясы мен энтропиясы қосындылары өзгерісінің бірнеше ықтимал нұсқасы болуы мүмкін. 1. 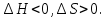 Реакция энергиялық жағынан тиімді және өздігінен жүзеге асады. Реакция энергиялық жағынан тиімді және өздігінен жүзеге асады.2. 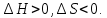 Реакция энергиялық жағынан тиімсіз және өздігінен жүре алмайды. Реакция энергиялық жағынан тиімсіз және өздігінен жүре алмайды.3. 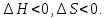 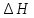 мәнінің төмендеуі өздігінен жүретін реакция үшін қолайлы,ал мәнінің төмендеуі өздігінен жүретін реакция үшін қолайлы,ал 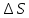 -тің төмендеуі бұған кедергі келтіреді.Реакцияның өздігінен жүру-жүрмеуі белгісіз. -тің төмендеуі бұған кедергі келтіреді.Реакцияның өздігінен жүру-жүрмеуі белгісіз.4. 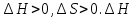 артуы реакцияның өздігінен жүруіне ықпал етпейді, артуы реакцияның өздігінен жүруіне ықпал етпейді,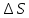 артуы оның ықтималдығын арттырады. Реакцияның өздігінен жүру-жүрмеуі белгісіз. артуы оның ықтималдығын арттырады. Реакцияның өздігінен жүру-жүрмеуі белгісіз.Мысалы: Айырылу реакциясының еркін энергиясының өзгеруін стандартты жағдайларын есептедім. N2O5(қ)=2NO2(г)+0,5O2(г)
Шешілуі: H 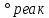 =2 =2 33,8-(-42,68)=110,28 кДж/моль 33,8-(-42,68)=110,28 кДж/моль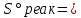 2 2 240,2+0,5205-178,24=404,66 Дж 240,2+0,5205-178,24=404,66 Дж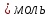 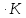 G 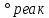 =110,28 (кДж/моль)-298(K) =110,28 (кДж/моль)-298(K) 0,40466 (кДж 0,40466 (кДж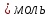 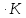 )= -10,309 кДж/моль )= -10,309 кДж/мольРеакцияның G 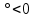 болғандықтан,реакция стандартты жағдайларда өздігінен жүреді. болғандықтан,реакция стандартты жағдайларда өздігінен жүреді.Реакция өздігінен жүретін температура аралығын бағалау үшін теңсіздікті шешу қажет G 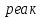 = H = H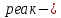 TS TS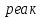 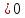 Осыдан H 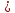 TS TS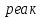 және және 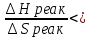 T T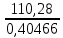 =272 =272 T TРеакция 272К немесе -1  -тан жоғары температурада өздігінен жүреді. -тан жоғары температурада өздігінен жүреді. |

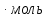 -1
-1