Основы калориметрии. Основы калориметрии
 Скачать 159.12 Kb. Скачать 159.12 Kb.
|
|
Министерство науки и высшего образования РФ Казанский государственный архитектурно-строительный университет Кафедра строительных материалов, изделий и конструкций РЕФЕРАТ по дисциплине: «Физико-химические основы оценки состояния объектов недвижимости» на тему: «Основы калориметрии» Выполнил: студент гр. 8ЭН01з Михайлова Р. А. Проверил: Доцент, кандидат технических наук Аюпов Д. А. Казань, 2022 Содержание ВВЕДЕНИЕ 2 1. Калориметр 4 2. Определение количества теплоты, полученного или потерянного за время опыта 4 3. Ртутные термометры, платиновые, термисторы, термопары, оптические пирометры 6 4. Методика проведения эксперимента. Начальный период, температурный ход, главный ход, главный период, конечный период 8 5. Кривая температура – время в калориметрическом опыте 9 6. Интегральная теплота растворения. Дифференциальная теплота растворения. Дифференциальная теплота разведения 11 Список литературы 14 ВВЕДЕНИЕНа разных этапах развития физики термину „теплота” давали различные трактовки. Согласно современным научным представлениям в любом теле не может быть запасена и измерена независимо друг от друга тепловая, электрическая или кинетическая энергия. Эти различные формы энергии взаимосвязаны и могут переходить друг в друга. Форма энергии, известная как теплота, связана только с обменом энергии между двумя или несколькими системами. Теплота всегда ассоциируется с тепловым потоком, что подчеркивает ее количественную природу. Таким образом, в количественном отношении теплота -- это количество энергии, которое обменивается в течение данного временного интервала в форме теплового потока. Для измерения теплоты, выделяемой или поглощаемой в различных процессах, используются приборы, называемые калориметрами. „Калориметрия” означает измерение теплоты. Калориметрия широко используется в разных областях науки и техники. 1. КалориметрКалори́метр (от лат. Calor — тепло и metor — измерять) — прибор для измерения количества теплоты, выделяющейся или поглощающейся в каком-либо физическом, химическом или биологическом процессе. Термин «калориметр» был предложен А. Лавуазье и П. Лапласом (1780). В физике элементарных частиц и ядерной физике используется ионизационный калориметр — прибор для измерения энергии частиц. Современные калориметры работают в диапазоне температур от 0,1 до 3500 К и позволяют измерять количество теплоты с относительной погрешностью от 0,01 до 10 %. Устройство калориметров весьма разнообразно и определяется характером и продолжительностью изучаемого процесса, областью температур, при которых производятся измерения, количеством измеряемой теплоты и требуемой точностью. 2. Определение количества теплоты, полученного или потерянного за время опытаПод теплотой сгорания понимается количество теплоты, выделяющейся при полном сгорании единицы топлива. Теплоту сгорания твердого и жидкого топлива обычно относят к 1 кг, а газообразного— к I м (в нормальных условиях) на рабочее, сухое или сухое безвольное состояние. По ГОСТ 147—74 с изменениями от 01.01.1981 г. и 01.01.1985 г. она определяется в калориметре. Продукты сгорания пробы топлива охлаждаются в калориметре до комнатной температуры. При этом вода, образующаяся при сгорании водорода и содержащаяся во влажном топливе, оказывается в жидком виде. Если в результате сгорания вода получается в виде жидкости, теплота сгорания называется высшей — Qs. В технических устройствах вода обычно выбрасывается вместе с продуктами сгорания в виде пара. Если в результате сгорания вода получается в виде пара, теплота сгорания называется низшей — Qi. Она меньше, чем Qs, на количество затрат теплоты на испарение. В СССР и ряде других стран обычно оперируют низшей теплотой сгорания на рабочее состояние Поскольку 1 кг водорода дает при сгорании 9 кг воды, а конденсация 1 кг пара при 20 °С — около 2,5 МДж теплоты , то приближенно Значения Максимальная теплота сгорания твердых топлив доходит до Теплота сгорания обезвоженных мазутов Калориметр позволяет определить теплоту сгорания с большей точностью, чем эта и аналогичные ей формулы, поэтому она используется как иллюстративная и иногда — для проверки точности элементного анализа. Теплоту сгорания газообразного топлива обычно относят к 1 м3 сухого газа (так называемая низшая теплота сгорания сухого газа 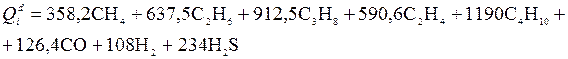 Здесь СН4, С2Н6 и т. д.— содержание соответствующих компонентов в газе, % по объему. С другой стороны, теплоту сгорания нетрудно определить экспериментально в калориметре. 3. Ртутные термометры, платиновые, термисторы, термопары, оптические пирометрыПриборы для измерения температуры основаны на изменении следующих свойств вещества при изменении температуры: На изменении объёма тела - термометры расширения: изменение линейного размера-дилатометры; изменение давления рабочего вещества в замкнутой камере - манометрические термометры. На изменении сопротивления - термометры сопротивления: термометры из благородных металлов - платины; термометры из неблагородных металлов; полупроводниковые термометры (термисторы). Основанные на явлении термоэффекта - термопары. Использующие оптические свойства вещества – оптические термометры или пирометры: радиационные пирометры; яркостные пирометры; цветовые пирометры. Измерение температуры жидкостными стеклянными термометрами основано на различии коэффициентов объемного расширения жидкости и материала оболочки термометра. Чувствительность термометра зависит от разности коэффициентов объемного расширения термометрической жидкости и стекла, от объема резервуара и диаметра капилляра. Чувствительность термометра обычно лежит в пределах 0,4…5 мм/С (для некоторых специальных термометров 100…200 мм/С). Для защиты от повреждений технические термометры монтируются в металлической оправе, а нижняя погружная часть закрывается металлической гильзой. Наиболее распространены ртутные стеклянные термометры. Ртуть не смачивает стекло, почти не окисляется, легко получается в химически чистом виде и имеет значительный интервал между точкой плавления (-38,86° С) и точкой кипения (+356,6°С). Недостаток ртути – сравнительно небольшой температурный коэффициент расширения. Основные недостатки жидкостных стеклянных термометров - невозможность регистрации и передачи показаний на расстояние, значительная тепловая инерция. Пирометр — прибор для бесконтактного измерения температуры тел. Принцип действия основан на измерении мощности теплового излучения объекта измерения преимущественно в диапазонах инфракрасного излучения и видимого света. Пирометры применяют для дистанционного определения температуры объектов в промышленности, быту, сфере ЖКХ, на предприятиях, где большое значение приобретает контроль температур на различных технологических этапах производства (сталелитейная промышленность, нефтеперерабатывающая отрасль). Пирометры могут выступать в роли средства безопасного дистанционного измерения температур раскаленных объектов, что делает их незаменимыми для обеспечения должного контроля в случаях, когда физическое взаимодействие с контролируемым объектом невозможно из-за высоких температур. Их можно применять в качестве теплолокаторов (усовершенствованные модели), для определения областей критических температур в различных производственных сферах. 4. Методика проведения эксперимента. Начальный период, температурный ход, главный ход, главный период, конечный периодЭксперимент следует начинать при условии, когда система близка к состоянию теплового равновесия, характеризуемого постоянным температурным ходом (не более 0,04 град/мин). При постоянной скорости изменения температуры производят 10 - 12 замеров по термометру Бекмана через каждые 30 секунд. Это начальный период калориметрического опыта. Далее в калориметре осуществляют необходимый эксперимент: растворяют соль, смешивают реагенты, включают нагрев и т.п. При этом температуру по термометру Бекмана продолжают непрерывно записывать через те же промежутки времени. За счет выделения или поглощения теплоты в процессе происходит резкое изменение температуры. Это главный период калориметрического опыта. По завершении главного периода вновь устанавливается равномерный ход температуры. Это конечный период калориметрического опыта, в течение которого производят еще 12 - 15 измерений температуры по термометру Бекмана. 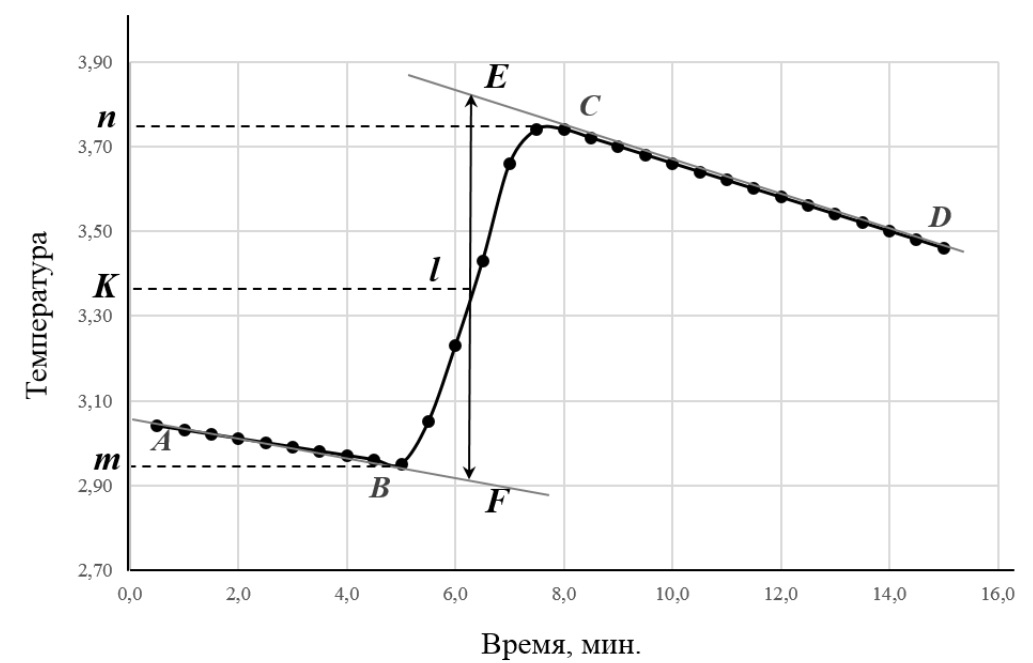 Рис. 1. Типичный вид температурной кривой калориметрического опыта при экзотермическом процессе в главном периоде. 5. Кривая температура – время в калориметрическом опытеВ ходе калориметрического опыта, проводимого в изотермическом калориметре, происходит теплообмен с окружающей средой, следствием чего являются тепловые потери в окружающую среду. Поэтому разница между температурами начала и конца изучаемого процесса обычно отличается от изменения температуры процесса, определённого в условиях, исключающих тепловые потери. Определить действительное значение по данным, полученным в результате калориметрического опыта, проведённого в изотермическом калориметре, можно двумя способами: аналитическим и графическим. Графический метод определения более прост, по точности не уступает аналитическому и позволяет с большей наглядностью судить об особенностях протекания процесса. Величину Δt с учетом теплообмена обычно рассчитывают графическим способом (см. рис. 1) Для этого результаты калориметрического опыта представляют графически на миллиметровой бумаге: по оси абсцисс откладывают время в масштабе 1 мин = 1 см, а по оси ординат – температуру, выбор масштаба которой зависит от величины Δt: если Δt ≤ 1º, то выбирают 1º = 10 см, если Δt ≥ 1º, то принимают 1º = 5 см. После того, как на график нанесены все экспериментальные точки, получается кривая ABCD. Участок АВ на ней соответствует начальному периоду, ВС – главному, а CD – конечному. Чтобы определить изменение температуры Δt, не искаженное теплообменом, происходящим в течение главного периода, продолжают АВ и CD до пересечения с вертикальной прямой EF. Для этого точки m и n, соответствующие начальной и конечной температурам главного периода, наносят на ось ординат. Через середину отрезка mn (точка К) проводят линию, пересечение которой с кривой ВС дает точку l, определяющую положение прямой EF. Отрезок EF и будет равен Δt, отрезок mn = Δt'. Чем меньше температурный ход в начальном и конечном периодах, тем меньше потери теплоты за счет теплообмена и тем ближе Δt' к Δt. Для определения тепловых эффектов в калориметрических опытах необходимо знать суммарную теплоемкость системы CW. Эту величину рассчитывают из опытных данных по уравнению (1.1), сообщив системе известное количество теплоты Q и определив графически Δt. Определенное количество теплоты можно сообщить системе, подведя к ней электрическую энергию или растворив соль с известной теплотой растворения. 6. Интегральная теплота растворения. Дифференциальная теплота растворения. Дифференциальная теплота разведенияОбразование неидеальных растворов сопровождается выделением или поглощением тепла. Тепловой эффект процесса при конечном изменении состава раствора называется интегральной теплотой растворения. Соответственно бесконечно малое изменение состава раствора сопровождается дифференциальной теплотой растворения. Для теплоты образования раствора при смешении двух чистых жидкостей имеем: ∆ΗΣ = Нраств. – (n1*H*1 + n2*H*2), где Нраств. – энтальпия раствора. Тогда интегральная теплота растворения определяется как (∆ΗΣ / n2), а интегральная теплота разведения - (∆ΗΣ / n1). Добавим к раствору i – го компонента при постоянных давлении и температуре dni молей. Изменение энтальпии будет равно разности между приращением энтальпии раствора и энтальпией добавляемого вещества:  Но величина  по определению, следовательно по определению, следовательно 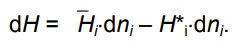 Из последнего равенства найдём дифференциальную теплоту растворения 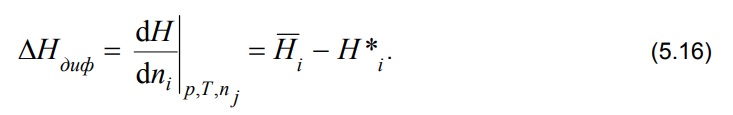 Дифференциальная теплота растворения равна разности между парциальной мольной энтальпией данного вещества в растворе и мольной энтальпией чистого вещества. Если под I-тым веществом понимается растворитель, то (5.16) определяет дифференциальную теплоту разбавления. Если к бесконечно большому количеству раствора добавляется один моль чистого растворителя, то тепловой эффект называют дифференциальной теплотой разведения. Заключение Калориметрия является распространенным и эффективным методом измерения количества теплоты, которое выделяется или поглощается при протекании различных физических или химических процессов. Не всегда есть возможность определить стандартную энтальпию образования вещества путем непосредственного измерения этой величины, так как реакция может не протекать или иметь малую скорость. В то же время теплоту сгорания, особенно органического соединения, сравнительно легко измерить. В настоящее время калориметрия сгорания является актуальным методом, используемым для определения стандартной энтальпии образования вещества. Список литературыhttp://refleader.ru/bewyfsotryfs.html https://www.muctr.ru/upload/university/departments/kfh/labw/labtherm/thermpract.pdfhttps://ru.wikipedia.org/wiki/Недвижимость https://mipt.ru/dmcp/upload/91c/2L_OXF04_06-arphaxxi9cn.pdfhttp://base.garant.ru/10164072/35/#friends http://refleader.ru/bewyfsotryfs.html https://studopedia.org/4-65162.html |
