Основы кристаллохимии. Правило Гольшмидта (многообразие кристаллических структур)
 Скачать 119.02 Kb. Скачать 119.02 Kb.
|
|
Часть 2. Основы кристаллохимии. Правило Гольшмидта (многообразие кристаллических структур). Многообразие кристаллических структур зависит от химической (структуры) природы и числа структурных единиц, размеров атомов или ионов, сил связи между ними, степени поляризации. Типы химических связей в кристаллах. Гомо- (изо-) десмические кристаллы – с одним типом связи. Гетеро- (анизо-) десмические – с несколькими типами связей. Ионная связь. Связь м/у атомами с большой разницей электроотрицательности. Ненаправленная, ненасыщенная. Металлическая связь. Связь в Ме. и сплавах м/у атом-ионами, образованная за счет обобществления электронов. Ненасыщенная, ненаправленная, большие координационные числа (8-12), плотные упаковки. Ковалентная связь. Связь м/у 2мя атомами, достигаемая путем обобществления неспаренных валентных электронов. Насыщаемая, направленная, малые координационные числа, отсутствие плотнейших упаковок. Электростатическая связь (самая сильная форма – водородная) – атом водорода одной молекулы слабо притягивается к атому более электроотрицательного элемента ругой молекулы. Ненасыщ., ненаправл. Ван-дер-ваальсовая связь – слабая связь, возникаемая в результате дипольных взаимодействий. Ненапр., ненасыщ., большие КЧ, ПУ. Атомные и ионные радиусы. Принцип расчета атомных и ионных радиусов. В кристаллохимии, как правило, пользуются эффективным радиусом атома или иона, под которым понимают сферу его действия (min расстояние, на которое центры сфер атомов могут приблизиться к поверхности соседних атомов) Д 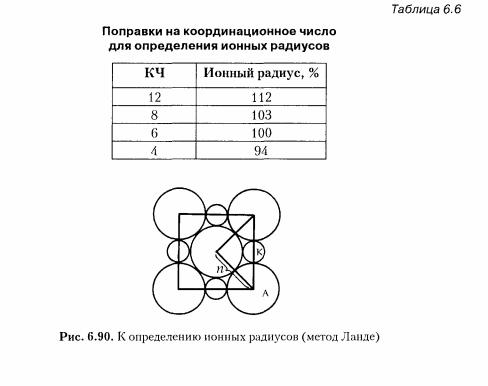 ля вычисления ионных радиусов всех элементов необходимо вычислить хотя бы один из них. ra=n/2 ля вычисления ионных радиусов всех элементов необходимо вычислить хотя бы один из них. ra=n/2Явления поляризации в кристаллах. Правила Фаянса. Поляризация – это способность атомов и ионов деформироваться под действием электрического поля. (Воздействие катиона на анион) Поляризация ионов, закономерности поляризации ионов (правила Фаянса): 1. Чем больше радиус ионов и чем меньше его заряд, тем больше поляризуемость. 2. Чем меньше радиус катионов и чем больше его заряд, тем интенсивнее поляризующее действие катионов. 3. Чем ближе электронная оболочка атома к оболочке благородного газа, тем меньше поляризационные эффекты Координационные числа и координационные многогранники (полиэдры). Координационные сферы. Координационнок число – число ближайших соседей (анионы окружают катион). Если ближайшие атомы или ионы соединить линиями, то получится координационный многогранник (полиэдр). КЧ: 2-гантель 3-треугольник 4-тетраэдр 6-октаэдр 8-куб 12-кубооктаэдр Координационная сфера – совокупность КЧ и полиэдра. Пределы устойчивости кристаллических структур (принцип формирования координации в ионных кристаллах). Правила Полинга (1929 г.): 1.Заряды каждого иона в структуре должны быть уравновешены зарядами их непосредственных соседей или, по крайней мере, находящихся от него на близком расстоянии – правило электронейтральности. 2.Наличие общих ребер (тем более граней) в структурных полиэдрах уменьшает устойчивость структуры. Структура считается устойчивой, если ион соприкасается только с противоположно заряженным ионом.
Предельные отношения радиусов ионов для различных КЧ (таблица Магнуса-Гольдшмдта): Способы изображения кристаллических структур. Существует три основных способа изображения кристаллических структур минералов на чертежах и в объемных моделях. 1-й способ: изображение шариков различных размеров и цветов в узлах кристаллической решетки 2-й способ: изображение атомов в виде сфер разного диаметра целиком заполняющие весь объем модели 3-й способ: изображение структуры с помощью других координатных полиэдров Теория плотнейших упаковок. ГПУ и КПУ, их симметрия. «О» и «Т» - пустоты. Количественные соотношения между плотноупакованными сферами и различными по форме пустотами. Теория ПУ. Атомы и ионы каждого элемента характеризуются определенной сферой действия, внутрь пределов, которой не могут проникать другие частицы. Анионы и катионы представляются в виде несжимаемых шаров соответствующих радиусов и должны быть упакованы в кристалле максимально плотно. Теория справедлива для кристаллов, в которых химическая связь ненаправленная и ненасыщенная. Типы плотнейших упаковок: 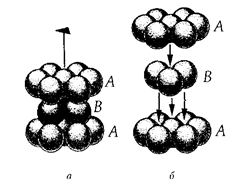 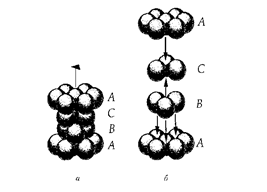 АБАБ...- гексагональная плотнейшая АБСАБС... - кубическая плотнейшая упаковка – ГПУ – 2х слойная упаковка – КПУ – 3х слойная Шары 2-го слоя заполняют лишь половину лунок предыдущего плотноупакованного слоя. При этом образуется два вида лунок: половина сквозных (1) и половина несквозных (2). 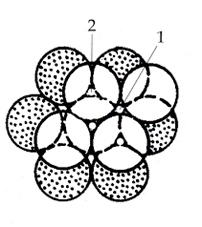 Характеристики плотнейших упаковок любой слойности. Плотнейшие упаковки характерны: • для структур простых соединений с ненаправленной и ненасыщаемой химической связью, т.е. структур металлов и благородно-газовых элементов: Mg, He – двухслойная упаковка, Cu, Ar – трехслойная упаковка, La – четырехслойная упаковка, • для структур с ионным типом связи, в которых крупные по размеру ионы (O2- , F- , Cl- , S2- ) создают плотнейшую упаковку, а мелкие (обычно катионы) располагаются в пустотах плотнейшей упаковки. • КЧ любого шара упаковки = 12, расстояния между шарами в слое и между слоев одинаковы, коэффициент заполнения пространства = 74,05 % Типы пустот в плотнейших упаковках:  а, б – тетраэдрическая, в, г – октаэдрическая, •Каждый шар любой плотнейшей упаковки окружен 8-ю тетраэдри- ческими и 6-ю октаэдри-ческими пустотами • Все плотноупакованное пространство разделяется без промежутков на октаэдры и тетраэдры • На каждый шар любой плотнейшей упаковки приходятся две тетраэдрические и одна октаэдрическая пустота 1 шар(узел) – О+2Т Многослойные упаковки. А В A C... (четырехслойная упаковка) P 6 3/m m c A B C A B ... (пятислойная упаковка P-3 m 1 A B C A C B… (шестислойная упаковка) P 6 3/m m c A B A B A C… (шестислойная упаковка ) P-6 m 2 A B C B C A C A B (девятислойная упаковка ) A B C A B C A C B A C B … (двенадцатислойная упаковка ) Структурные единицы кристаллов, структурные формулы минералов. Структурная единица - элементарная ячейка пространственной решетки, которая занимает минимально возможный объем и обладает всеми свойствами трехмерной кристаллической решетки. Элементарная ячейка кристаллической решетки считается определенной, когда известна природа и положение частиц, образующих кристалл, длина ребер a, b, с и величина углов α, β и γ между гранями ячейки (рис. 1). 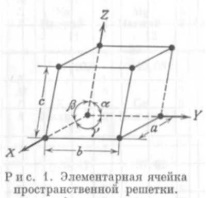 Т.к. химический состав и структура связаны между собой, для выражения этой взаимосвязи используется структурная формула. Категории структур: координационные, островные, цепочечные, слоистые, каркасные. Категории структур: -координационные (все координационные полиэдры соединены друг с другом общими гранями и рёбрами. В таких структурах присутствует только один тип связи по всем направлениям (гомодесмические) -островные (структуры, в которых отчетливо выделяются устойчивые группировки, не соприкасающиеся друг с другом и соединенные только с помощью общих анионов и катионов) -цепочечные (состоят из полиэдров, связанных в бесконечные цепочки (с ковалентной связью внутри цепочек и чаще ионной между ними). -ленточные структуры (состоят из полиэдров, связанных в сдвоенные цепочки) -слоистые (состоят из валентно-насыщенных слоев) -каркасные (представляют собой трёхмерную сетку из атомных группировок с достаточно большими пустотами. Связи м/у атомами ионные и ковалентные) Изодесмические (гомодесмические) структуры: координационные (координационно-равные). Анизодесмические (гетеродесмические) структуры. Все категории структур кроме координационных. Структурные типы, изоструктурность. Структурный тип- закономерное пространственное расположение атомов и ионов кристаллических веществ. Изоструктурность- одинаковый структурный тип при разном химическом составе. Изоморфизм. Условия изоморфизма. Виды изоморфизма (по типу компенсации валентности, по совершенству, по направленности). Диагональные ряды изоморфизма. Изоморфизм:1) свойство химически и геометрически близких атомов, ионов и их сочетаний замещать друг друга в химических соединениях; 2) свойство минералов родственного состава и структуры образовывать ряд смешанных гомогенных минералов одинаковой кристаллической структуры – изоморфные смеси или твердые растворы. Однородные (гомогенные) кристаллические фазы переменного состава, образуется в двойных или многокомпонентных системах. Компонент в системе – минал. Изоморфизм различается: 1.По типу компенсации валентности: изовалентный (замещающие друг друга атомы имеют одинаковую валентность) гетеровалентный. 2.По степени совершенства: совершенный(неограниченный) (когда возможна полная замена одних атомов другими, т.е. могут существовать два крайних и все промежуточные по составу минералы) несовершенный(ограниченный) (когда количество изоморфной примеси не может превышать какого-то предела, неоднозначного для разных минералов и примесей) 3.Направленный изоморфизм. 4.По количеству атомов, участвующих в изоморфизме: двухатомный и многоатомный изоморфизм. Распад твердого раствора (экссолюция). При высоких температурах в результате расширения кристаллической решетки пределы допускаемых замещений становятся менее жесткими, и возможности образования твердых растворов возрастают, т.е. поля составов расширяются. Рассмотрим, что произойдет в результате охлаждения минерала, состав которого, устойчивый при высоких температурах, становится неустойчивым при понижении температуры. Если охлаждение происходит резко, т. е. если кристалл подвергается закалке, то его высокотемпературная структура оказывается замороженной. При менее резком охлаждении атомы успевают перегруппироваться, принимая частично или полностью упорядоченное пространственное расположение. В конечном счете структура может разрушиться с образованием двух веществ, имеющих различный состав, но близкую структуру. Этот последний процесс называется распад твердого раствора (экссолюция). Описанное явление присуще многим минеральным системам, в число которых входят полевые шпаты, пироксены, амфиболы, а также различные оксидные и сульфидные минералы. Для процессов распада твердых растворов характерно, что новообразованные минеральные обособления состоят из ориентированных сросшихся кристаллических пластинок. Преобладающий минерал называется минералом-хозяином, а пластинки второго относятся к продуктам распада Диаграммы изоморфных смесей. Если два вещества смешать друг с другом в определенных пропорциях и смесь нагреть до высокой температуры, то в подавляющем большинстве случаев образуется совершенно однородная жидкость, представляющая собой раствор одного компонента в другом. Некоторые системы дадут два жидких слоя взаимно насыщенных растворов, и только немногие будут совершенно нерастворимы друг в друге ни при каких условиях. Это относится к таким веществам, которые не разлагаются до температуры плавления. Физические свойства изоморфных смесей. Физические свойства минералов можно объединить в группы: оптические свойства (кристаллооптические и спектроскопические), механические, плотность, электрические, магнитные, вращательные (вращение плоскости поляризации), свойства, связанные с наличием полярных направлений (пиро- и пъезоэлектричество). Физические свойства С. изучены хорошо и для них, по-видимому, найден общий закон зависимости от состава. Этот закон может быть формулирован так: физические свойства С. аддитивны, т. е. представляют собой сумму соответственных величин свойств компонентов смеси. Иначе говоря, удельные веса, коэффициенты преломления и т. п. С. равны вычисленным по правилу смешения из величин удельных весов, коэффициентов преломления веществ, входящих в состав смеси. Малляр установил этот закон на основании исследований оптических свойств С., Рётгерс распространил его на удельные веса. До настоящего времени нет фактов, противоречащих этому закону, и можно предполагать, что все физические свойства С. подчинятся ему. Результатом аддитивности физических свойств является то, что для ряда смесей, образованных двумя изоморфными веществами, зависимость между величинами физических свойств их и химическим составом может быть выражена уравнением кривой первого, второго или высшего порядка, коэффициенты которого суть функции величин физических свойств двух взятых веществ. Полиморфизм, фазовые переходы, их типы. Полиморфизм– способность твердых веществ образовать при одном химическом составе в разных условиях различные по строению кристаллические структуры и, соответственно, формы кристаллов. Полиморфные модификации имеют собственное название и могут различаться: координационными числами, типом связи, типом ПУ, мотивом расположения катионов, поворотом некоторых структурных элементов, вращением радикалов в кристаллической структуре. Полиморфные переходы: монотронные( необратимые); энантиотропные( обратимые); переходы с изменением и без изменения первой координационной сферы.; переходы с вращением отдельных групп атомов.; переходы с изменением степени упорядоченности атомов. Фазовые диаграммы полиморфных модификаций. Каждая модификация устойчива в определённой области температуры, давления, а также других внешних условий. Фазовые диаграммы равновесия определяют области устойчивости полиморфных модификаций (Диаграмма состояния). Теоретический расчёт фазовых диаграмм основан на вычислении термодинамических характеристик, а также энергии и спектра колебаний кристаллической решётки для различных полиморфных модификаций. Таким образом, различают два вида полиморфизма. Первый вид, - "энантиотропия" - характеризуется обратимостью переходов полиморфных модификаций из одной в другую при определённых температурах и давлениях. Примером энантиотропии могут служить переходы кварца в высокотемпературную разновидность SiO2 - тридимит, а также переходы алмаза в графит. Второй вид, - "монотропия", - когда одна полиморфная модификация (нестабильная) может переходить в другую (стабильную) , но обратный переход невозможен. Примером монотропии является переход марказита в пирит, а также превращение ромбического арагонита в тригональный кальцит (при нагревании). Наиболее строгая классификация полиморфных переходов основана на степени и характере изменения структуры. Каждая Политипизм, обозначения политипов. Политипизм – различная последовательность укладки идентичных слоев в структуре слиостых минералов (слюды, глины) или различные развороты слоев относительно друг друга. (Способность одного и того же вещества кристаллизоваться в нескольких слоистых структурных модификациях, различающихся только поворотом или порядком чередования слоёв.) Обозначение политипов: цифра – количество слоев, буква – симметрия ячейки. Тк – триклинная, М – моноклинная, О-ромбическая, R-ромбоэдрическая, Н- гексаганальная, С – кубическая. SiC- политип 594 R. Морфотропия. Морфотропия (греч. μορφή — «форма» и др.греч. τροπή — «поворот») — термин кристаллохимии, понятие, обратное изоморфизму. Обозначает изменение кристаллической структуры соединения при замене в химической формуле одного из атомов на атом, соседний по группе в периодической системе. В качестве примера морфотропии можно привести ряд карбонатных минералов: сидерит FeСО3, родохрозит МnСО3, магнезит МgСО3, где кристаллическая структура зависит от ионного радиуса катиона. |
