Основные этапы развития микробиологии и иммунологии
 Скачать 7.66 Mb. Скачать 7.66 Mb.
|
|
Риккетсии — мелкие палочковидные грам-отрицательные бактерии из рода Rickettsia, облигатно паразитирующие в цитоплазме или в цитоплазме и ядре эукариотных клеток. Жизненный цикл Р. связан с членистоногими, которые для большинства этих бактерий являются первичными хозяевами или переносчиками. У человека Р. вызывают острые лихорадочные заболевания —риккетсиозы. Наибольшее значение имеют возбудители эпидемического сыпного тифа (R. prowazekii), клещевого риккетсиоза (R. sibirica), пятнистой лихорадки Скалистых гор (R. rickettsii), лихорадки цуцугамуши (R. tsutsugamushi). Риккетсии обладают тропизмом к клеткам эндотелия сосудов. Чувствительны к большинству антибиотиков широкого спектра действия, особенно тетрациклинового ряда. В оптимальных условиях клетки Р. имеют форму коротких палочек размером в среднем 0,2—0,6 ´ 0,4—2,0 мкм. Их форма и размеры могут несколько меняться в зависимости от фазы роста (логарифмическая или стационарная). При изменении условий роста они легко образуют клетки неправильной формы или нитевидные. На поверхности мембраны клеточной стенки располагается капсулоподобный слизистый покров и микрокапсула, содержащие группоспецифичный«растворимый» антиген. В клеточной стенке локализуются основные белки, большинство из которых являются видоспецифичными антигенами, а также липополисахарид и пептидогликан. В цитоплазматической мембране преобладают ненасыщенные жирные кислоты, она осмотическиактивна, имеет специфическую транспортную систему АТФ — АДФ. Нуклеоид клетки Р. содержит кольцевую хромосому. Риккетсии культивируются в желточных мешках куриных эмбрионов, перевиваемых культурах клеток, легких белых мышей. Размножаются путем бинарного деления, обладают независимым от клетки-хозяина метаболизмом. Источником энергии у внеклеточных Р. служит глутамат. Возможно, что при размножении получают макроэргические соединения из клетки-хозяина. Способны индуцировать свой фагоцитоз эукариотной клеткой. Размножаются простым поперечным делением. Выделяют 2 типа деления: 1) обычное деление a– (кокковидных, по Здродовскому) и b– (палочковидных двузернистых) форм с образованием гомогенных популяций 2) размножение мицелия дроблением нитевидных d–форм с последующим образованием популяций, состоящих из клеток a- и b-типов. Тип С занимает промежуточное положение между a-, b- и d-формами, – это удлинённые или изогнутые двузернистые палочки. Основные способы окраски По Граму риккетсий окрашиваются отрицательно. Для их дифференциации чаще применяется предложенная П.Ф. Здродовскимоблегченная модификация способа Пиля – Нельсена: окраска водным фуксином (5 мин) С последующей обработкой мазка 0,01 % раствором соляной кислоты (1 – 3 с) и докрашиванием 0,5 % метиленовым синим (10 с). Обладая относительной кислотоустойчивостью, риккетсий при этом окрашиваются в рубиново – красный цвет и легко обнаруживаются на фоне голубой цитоплазмы или синего ядра клеток. окрашиваются в сиреневый цвет; при внеклеточном расположении часто имеют вид биполярных палочек или гантелек. Спор, капсул и жгутиков не образуют Для первичного выделения Р. используют преимущественно взрослых самцов морских свинок и взрослых белых, линейных и бестимусных мышей. Билет 6.Систематика и номенклатура бактерий.Принципы классификаций.Понятия вид, подвид,хемовар,штаммы. Систематика - распределение микроорганизмов в соответствии с их происхождением и биологическим сходством. Систематика занимается всесторонним описанием видов организмов, выяснением степени родственных отношений между ними и объединением их в различные по уровню родства классификационные единицы - таксоны. Основные вопросы, решаемые при систематике (три аспекта, три кита систематики) - классификация, идентификация и номенклатура. Классификация - распределение (объединение) организмов в соответствии с их общими свойствами (сходными генотипическими и фентипическими признаками) по различным таксонам. Таксономия - наука о методах и принципах распределения (классификации) организмов в соответствии с их иерархией. Наиболее часто используют следующие таксономические единицы (таксоны) - штамм, вид, род. Последующие более крупные таксоны - семейство, порядок, класс. Идентификация – установление видовой принадлежности микроорганизма по морфологическим, тинкториальным, культуральным, биохимическим и антигенным свойствам. Номенклатура - название микроорганизмов в соответствии с международными правилами. Все микроорганизмы подразделяются на неклеточные и клеточные формы. К неклеточным формам относятся: прионы, вироиды, вирусы. К клеточным формам относятся три домена: «Bacteria», «Archaea» - прокариоты, «Eukarya» - эукариоты. К прокариотам относятся бактерии и архебактерии, к эукариотам - грибы и простейшие. Вид – это совокупность особей, объединенных по близким свойствам, но отличающихся от других представителей рода. Подвид, инфравид – популяция бактерий, отличающихся от основного вида по какому-либо признаку или признакам, которые могут быть детализированы как варианты Штамм – совокупность особей одного вида, выделенные из одного источника, но в разное время или из разных источников Вид не является конечной единицей систематики. Внутри вида выделяют варианты микроорганизмов, отличающиеся отдельными признаками. Так, различают: 1) серовары (по антигенной структуре); 2) хемовары (по чувствительности к химическим веществам); 3) фаговары (по чувствительности к фагам); 4) ферментовары; Бактериоцины – вещества, продуцируемые бактериями и губительно действующие на другие бактерии. По типу продуцируемого бактериоцина различают бактериоциновары, а по чувствительности – бактерициногеновары. Для видовой идентификации бактерий необходимо знать следующие их свойства: 1) морфологические (форму и структуру бактериальной клетки); 2) тинкториальные (способность окрашиваться различными красителями); 3) культуральные (характер роста на питательной среде); 4) биохимические (способность утилизировать различные субстраты); 5) антигенные. Билет 7.Простые и сложные способы окраски бактерий.Основные методы исследования бактерий.  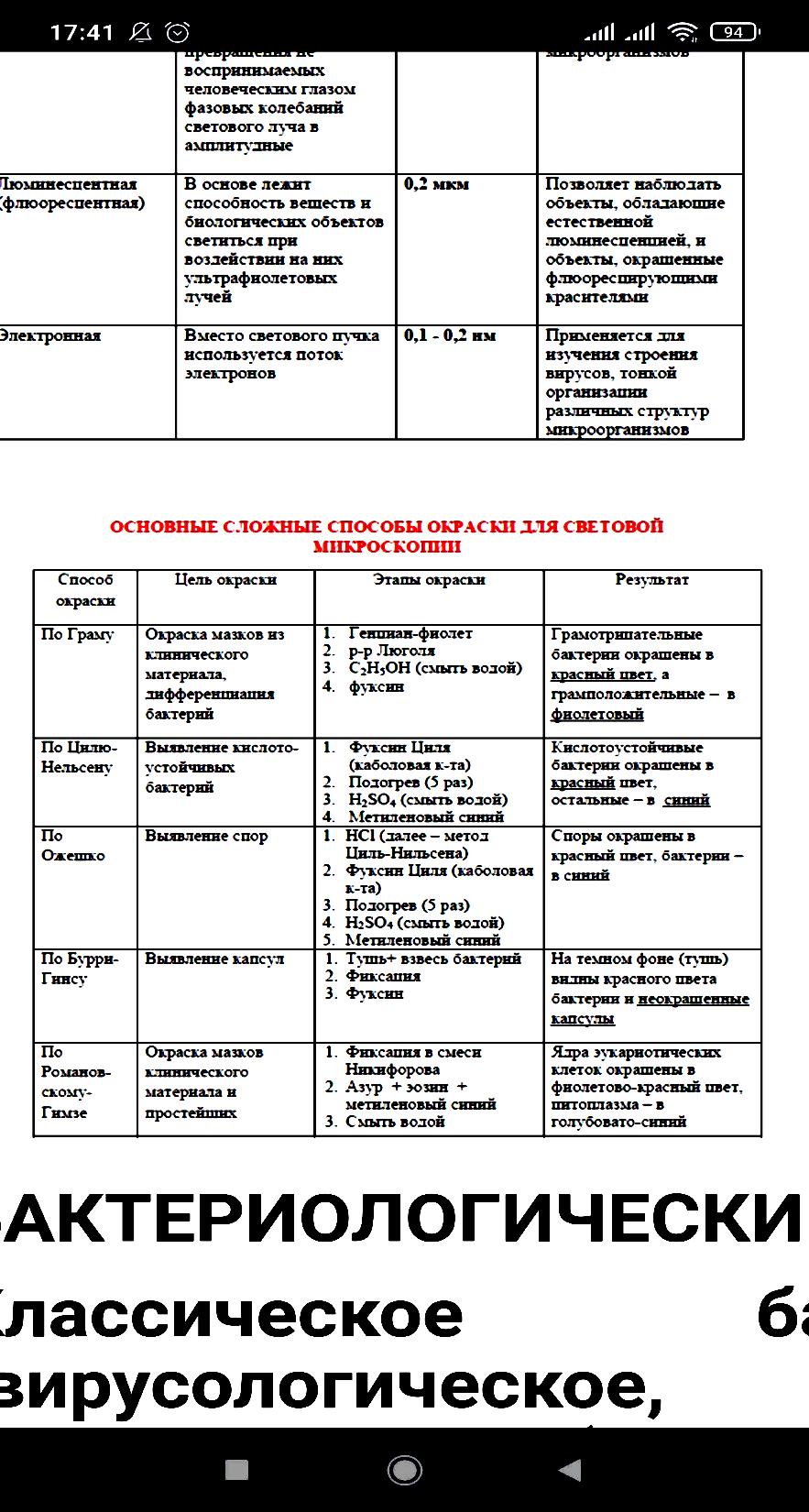     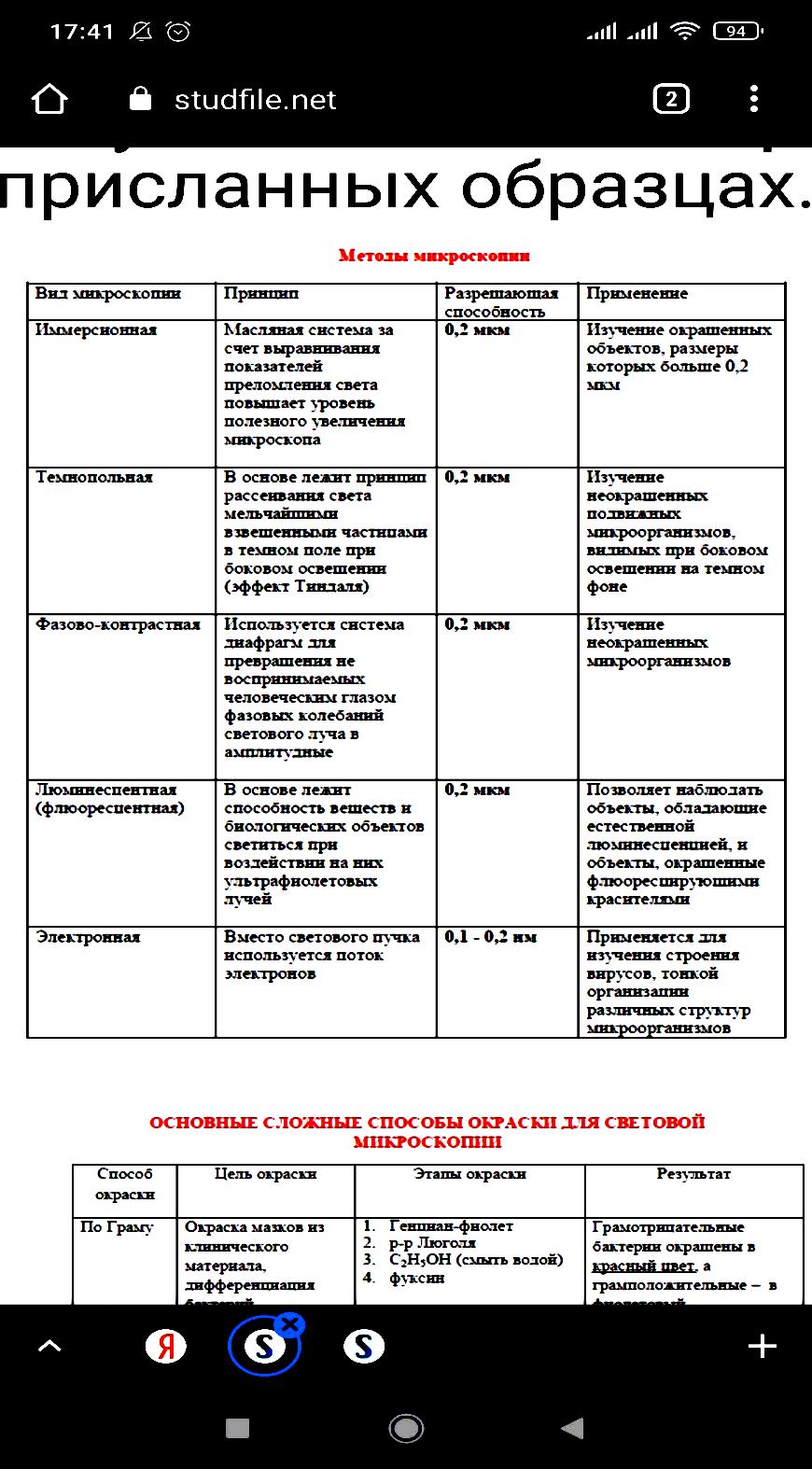 Общая микробиология 8. Питательные среды и их классификация. Требования, предъявляемые к питательным средам Микроорганизмы культивируют на питательных средах. Питательные среды подразделяются на группы в зависимости от свойств. По физическому состоянию питательные среды подразделяются на: - жидкие среды; - полужидкие среды; - твердые (плотные) среды; Жидкие среды представляют собой настои, отвары, бульоны, приготовленные на основе мяса, рыбы, овощей (естественные среды), а также композиции определенных концентраций химических соединений (искусственные среды). Полужидкие среды получают путем добавления к жидким средам 0,5-0,9% агар-агара (желеобразующее вещество, получаемое из морских водорослей). К плотным питательным средам относят среды, содержащие 2-3% агара. По сложности питательные среды подразделяются на: - простые, или обычные среды (пептонная вода, мясо-пептонный бульон, мясо-пептонный агар); - сложные, или специальные среды (кровяной агар, асцитический агар и бульон, мясо-пептонный сахарный бульон, сывороточный агар и бульон, свернутая сыворотка, кровяной бульон). По происхождению питательные среды подразделяются на: - естественные среды; - полусинтетические среды; - синтетические среды. Естественные питательные среды - это природные органические среды непостоянного состава, которые включают продукты животного или растительного происхождения. К ним относятся пептоны, кровь, отвары и экстракты, полученные из природных субстратов (мясо, рыба, крупы). Полусинтетические среды кроме органических и неорганических веществ известного состава содержат продукты природного происхождения (картофельная среда с глюкозой, дрожжевая среда). Синтетические питательные среды состоят из определенных количеств органических и неорганических химических соединений известного состава. Готовые питательные среды должны: удовлетворять потребностям обмена веществ микробной клетки; легко усваиваться бактериями; содержать необходимые соли (NaCl,K,Mg,Ca); быть стерильными; иметь оптимальную рН; иметь достаточную влажность (плотная среда должна иметь не меньше 60% влаги); содержать факторы роста. Билет 9(общая микра.)Производные микробной клетки.(споры; капсулы; жгутики) Структурные компоненты бактериальной клетки делят на 2 вида: - основные структуры (клеточная стенка, цитоплазматическая мембрана с ее производными, цитоплазма с рибосомами и различными включениями, нуклеоид); - временные структуры (капсула, слизистый чехол, жгутики, ворсинки, эндоспоры, образующиеся лишь на определенных этапах жизненного цикла бактерий). К временным структурам относятся капсула, жгутики, пили, эндоспоры бактерий. Капсула - это слизистый слой над клеточной стенкой бактерии. Вещество капсул состоит из нитей полисахаридов. Капсула синтезируется на наружной поверхности цитоплазматической мембраны и выделяется на поверхность клеточной стенки в специфических участках. Функции капсулы: - место локализации капсульных антигенов, определяющих вирулентность, антигенную специфичность и иммуногенностьбактерий; - защита клеток от механических повреждений, высыхания, токсических веществ, заражения фагами, действия защитных факторов макроорганизма; - способность прикрепления клеток к субстрату. Жгутики – это органы движения бактерий. Жгутики не являются жизненно важными структурами, поэтому могут присутствовать у бактерий или отсутствовать в зависимости от условий выращивания. Количество жгутиков и места их расположения у разных бактерий неодинаково. В зависимости от этого выделяют следующие группы жгутиковых бактерий: - монотрихи – бактерии с одним полярно расположенным жгутиком; - амфитрихи – бактерии с двумя полярно расположенными жгутиками или имеющие по пучку жгутиков на обоих концах; - лофотрихи – бактерии, имеющие пучок жгутиков на одном конце клетки; - перитрихи – бактерии с множеством жгутиков, расположенных по бокам клетки или на всей ее поверхности. Химический состав жгутиков представлен белком флагеллином. К поверхностным структурам бактериальной клетки относятся также ворсинки и пили. Эти структуры участвуют в адсорбции клеток на субстрате (ворсинки, пили общего типа) и в процессах переноса генетического материала (половые пили). Они образованы специфическим гидрофобным белком пилином. У некоторых бактерий в определенных условиях образуются покоящиеся формы, которые обеспечивают переживание клеток в течение длительного времени в неблагоприятных условиях - эндоспоры. Они устойчивы к неблагоприятным факторам внешней среды. Расположение спор в клетке: - центральное (возбудитель сибирской язвы); - субтерминальное - ближе к концу (возбудитель ботулизма); - терминальное – на конце палочки (возбудитель столбняка). Методы выявления капсул, жгутиков, спор Для выявления некоторых бактерий и отдельных структур клеток применяют специальные методы окраски. Окраска кислотоустойчивых бактерий по методу Циля-Нильсена: 1. На фиксированный мазок наносят карболовый раствор фуксина через полоску фильтровальной бумаги и подогревают до появления паров в течение 3-5 минут. 2. Снимают бумагу, промывают мазок водой. 3. На мазок наносят 5% раствор серной кислоты или 3% раствор солянокислого спирта на 1-2 минуты для обесцвечивания. 4. Промывают водой. 5. Докрашивают мазок водным раствором метиленового синего в течение 3-5 минут. 6. Промывают водой, высушивают и микроскопируют. Выявление капсулы по методу Гинса: 1. На предметное стекло наносят каплю туши, а рядом – каплю исследуемого материала. Обе капли тщательно перемешивают и с помощью шлифованного стекла готовят мазок. 2. Мазок высушивают на воздухе и фиксируют на пламени горелки. 3. Мазок окрашивают фуксином в разведении 1:3 или сафранином. При этом бактерии окрашиваются в красный цвет, капсулы остаются неокрашенными и выделяются на темном фоне препарата. Окраска жгутиков по Леффлеру: 1. Взвесь бактерий переносят в каплю воды, не перемешивают и высушивают. 2. Обрабатывают препарат 15-20 минут протравой (1 мл насыщенного спиртового раствора фуксина + смесь из 10 мл 25% водного раствора танина с 5 мл насыщенного водного раствора сернокислого железа). 3 Тщательно промывают водой и высушивают на воздухе. 4. Докрашивают фуксином Циля в течение 3-4 минут при легком подогревании. 5 Промывают водой, высушивают, микроскопируют. Окраска спор по методу Ожешки: 1. На нефиксированный мазок наносят 0,5% раствор хлористоводородной кислоты и подогревают на пламени горелки в течение 2-3 минут. 2. Кислоту сливают, препарат промывают водой, просушивают и фиксируют над пламенем горелки. 3. Окрашивают препарат по Цилю-Нильсену. Споры бактерий при этом приобретаю красный цвет, а вегетативные формы – синий. Изучение микробов в живом состоянии Клетки микроорганизмов в живом состоянии изучают методом раздавленной капли и методом висячей капли. Метод раздавленной капли. На поверхность обезжиренного предметного стекла наносят каплю исследуемого материала или суспензию бактерий и покрывают ее покровным стеклом. Капля должна быть небольшой, не выходящей за края покровного стекла. Микроскопируют препарат с объективом х40. Метод раздавленной капли удобен для исследования подвижности бактериальных клеток, а также для изучения крупных микроорганизмов - плесневых грибов, дрожжей. Метод висячей капли. Препарат готовят на покровном стекле, в центр которого наносят каплю бактериальной суспензии. Затем предметное стекло с лункой, края которого предварительно смазывают вазелином, прижимают к покровному стеклу так, чтобы капля находилась в центре лунки. Препарат переворачивают покровным стеклом вверх. В правильно приготовленном препарате капля должна свободно висеть над лункой, не касаясь ее дна или края. Для микроскопии используют вначале малый сухой объектив х8, под увеличением которого находят края капли, а затем устанавливают объектив х40 и исследуют препарат. Билет 10.(общая микра)Методы выявления чистых культур аэробных микроорганизмов. Методы выделения чистых культур аэробов. Процесс выделения чистой культуры можно разделить на несколько этапов. Первый этап. Из исследуемого материала готовят мазок, окрашивают его по Граму или другим методом и микрсгскопиру-ют. Для посева исследуемый материал в случае необходимости разводят в пробирке со стерильным изотоническим раствором хлорида натрия. Одну каплю приготовленного разведения наносят петлей на поверхность питательного агара в чашку Петри и тщательно втирают шпателем в среду, равномерно распределяя материал по всей ее поверхности. После посева чашку переворачивают дном кверху, подписывают и помещают в термостат при температуре 37 °С на 18—24 ч. Второй этап. Просматривают чашки и изучают изолированные колонии, обращая внимание на их форму, величину, консистенцию и другие признаки. Для определения морфологии клеток и их тинкториальных свойств из части исследуемой колонии готовят мазок, окрашивают по Граму и микроскопируют. Для выделения и накопления чистой культуры одну изолированную колонию или несколько различных изолированных колоний пересевают в отдельные пробирки со скошенным агаром или какой-либо другой питательной средой. Для этого часть колонии снимают петлей, не задевая соседние колонии. Третий этап: Отмечают характер роста выделенной чистой культуры. Визуально чистая культура характеризуется однородным ростом. При микроскопическом исследовании окрашенного мазка, приготовленного из такой культуры, в нем обнаруживаются морфологически и тинкториально однородные клетки. Очнако в случае выраженного полиморфизма, присущего некоторым видам бактерий, в мазках из чистой культуры наряду с типичными встречаются и другие формы клеток. Билет 11.(общая микра)Методы выявления чистых культур анаэробных микроорганизмов. Методы выделения чистых культур анаэробов. Питательные среды для анаэробов должны отвечать следующим основным требованиям: 1) удовлетворять питательным потребностям; 2) обеспечивать быстрый рост микроорганизмов; 3) быть адекватно редуцированными Посевы с целью выделения анаэробной микрофлоры, как спо-рообразующей (клостридии), так и неспорообразующей (вейлонеллы, бактероиды, пептококки), производят в строго анаэробных условиях. Первичные посевы делают на обогатительные среды (тиогликолевую, Китта — Тароцци), затем пересевают на плотные среды: сахарный кровяной агар в чашки Петри, в высокий столбик сахарного питательного агара или другие среды для получения изолированных колоний. После инкубации посевов в анаэробных условиях из образовавшихся колоний бактерий готовят мазки, окрашивают, микроскопируют, а затем пересевают на среду Китта — Тароцци и агаровые среды для выделения чистой культуры. При выделении спорообразующих анаэробных бактерий (клостридии) первоначальные посевы прогревают на водяной бане при температуре 80 °С в течение 20 мин для уничтожения вегетативных клеток посторонней микрофлоры, которая может присутствовать в исследуемом материал Билет 12. Исследование биохимической активности микроорганизмов. Исследование подвижности. Методы микробиологического диагноза Биохимическая активность микроорганизмов, ее определение. Для определения способности МКО ферментировать углеводы используют короткий и длинный «пестрый» ряд. К первому относятся жидкие питательные среды Гисса с моно- и дисахаридами: глюкозой, лактозой, мальтозой, маннитом. В длинный пестрый ряд наряду с этими углеводами вводят среды с разнообразными моносахаридами (арабиноза, ксилоза), полисахаридами (инулин, крахмал) и спиртами (глицерин, инозит). В качестве индикатора ко всем средам добавляют индикатор – реактив Андреде или ВР. Чистую культуру засевают петлей в среды «пестрого» ряда. Инкубируют при темп. 37 град. в течении 18-24 ч. Если бактерии ферментируют углеводы до образования кислых продуктов, наблюдается изменение цвета среды; при разложении до кислоты и газа помимо изменения цвета появляется пузырек газа в поплавке. Если используются среды с полужидким агаром, то образование газа регистрируется по разрыву столбика. • Реакция на аммиак. Узкую полоску лакмусовой бумаги укрепляют под пробкой так, чтобы она не соприкасалась с питательной средой. Посинение бумаги свидетельствует об образовании аммиака. • Реакция на индол. Способ Эрлиха: в пробирку с культурой бактерий прибавляют 2-3 мл эфира, содержимое перемешивают и добаляют несколько капель реактива Эрлиха (спиртовой раствор парадиметиламидобензальегида с хлороводородной кислотой). В присутствии индола наблюдается розовое окрашивание, при осторожном наслаивании образуетсяся розовое кольцо. • Реакция на сероводород. Делают посев культуры бактерий уколом в столбик с питательной средой, содержащей реактивы для выявления сероводорода (смесь солей: сульфат железа, тиосульфат натрия, сульфат натрия). При наличии сероводорода происходи почернение агара. • Обнаружение каталазы. На предметное стекло наносят каплю 1-2% р-ра пероксида водорода и вносят в нее петлю с бактеральной культурой. Каталаза разлагает перекись на кислород и воду. Выделение пузырьков кислорода свидетельствует о наличии каталазы. Изучение бактерий на подвижность Практически изучение микробов в живом состоянии применяется для определения подвижности, то есть косвенного подтверждения наличия жгутиков. Движение микробов можно наблюдать в препаратах «раздавленная капля» или «висячая капля». Микроскопируют эти препараты сухим или иммерсионным объективом. Метод «раздавленной» капли. На середину предметного стекла наносят каплю исследуемого материала. Каплю накрывают покровным стеклом так, чтобы не появились пузырьки воздуха; жидкость должна заполнять все пространство и не выступать за края стекла. Недостатком метода «раздавленной» капли является быстрое высыхание препарата. При длительном микроскопировании препарата рекомендуют смазывать края покровного стекла вазелином. Кроме того, можно использовать метод «висячей» капли. Метод «висячей» капли. Для приготовления этого препарата используют специальные предметные стекла с углублением («лункой») в центре. Небольшую каплю исследуемого материала наносят на середину покровного стекла, края лунки предварительно смазывают вазелином. Предметное стекло накладывают на покровное так, чтобы капля находилась в центре лунки. Затем его осторожно переворачивают, чтобы капля свисала в центре герметично закрытой полости лунки. В такой замкнутой полости капля защищена от высыхания  |
