Определение витамина С. определение витамина С. Особенности качественного и количественного определения витамина с в школьной лаборатории. Оглавление
 Скачать 39.86 Kb. Скачать 39.86 Kb.
|
|
«Особенности качественного и количественного определения витамина С в школьной лаборатории». ОГЛАВЛЕНИЕ:
Введение. К группе витаминов относятся низкомолекулярные органические соединения разной химической природы. Вещества объединяются в группу витаминов по признаку абсолютной необходимости их для организма в качестве составной части пищи. Высокая значимость витаминов для организма человека объясняет то, что их изучение начинается ещё в начальной школе и заканчивается в старших классах, в курсе химии и биологии. Использование методов количественного и качественного анализа позволяет наглядно доказать наличие витаминов в продуктах питания. Выбор для анализа витамина С обусловлен тем, что он является наиболее доступным витамином для проведения качественного и количественного анализа и с учётом его большого значения для нормального протекания биологических процессов в организме. Цель работы: Провести качественный и количественный анализ витамина С в условиях школьной лаборатории. Данная цель конкретизируется следующими задачами: 1) Познакомиться с методиками качественного и количественного анализа витамина С, доступных для проведения в условиях школьной лаборатории. 2) Провести качественный и количественный анализ витамина С в растворе и в продуктах питания, на примере сока яблок. 3) Проанализировать возможность использования данных методов в школе. Практическим результатом работы должны стать рекомендации по использованию методов количественного и качественного анализа витамина С в школе. 1. Значение витамина С для организма. Витамин С, являясь мощным антиоксидантом, предохраняет организм от бактерий и вирусов, оказывает противовоспалительное и противоаллергическое действие, укрепляет иммунную систему и усиливает действие других антиоксидантов, таких как селен и витамин Е. Прием ударной дозы витамина С поможет преодолеть любое простудное заболевание, ускорит заживление ран. Также витамин С оказывает влияние на синтез ряда гормонов, в том числе антистрессовых, регулирует процессы кроветворения и нормализует проницаемость капилляров, участвует в синтезе белка коллагена, что необходимо для роста клеток тканей, костей и хрящей организма, улучшает способность организма усваивать кальций, выводит токсины, регулирует обмен веществ. Витамин С давно известен как лекарство для больных цингой. А по последним данным он еще и обладает антираковыми свойствами, снижает интоксикацию организма у алкоголиков и наркоманов, и даже замедляет процесс старения организма.(4) 2. Химическая природа витамина С. Строение витамина С было окончательно установлено синтезом его из L-кислоты. Витамин С получил название L-аскорбиновой кислоты, которая представляет собой кристаллическое соединение, легко растворимое в воде с образованием кислых растворов. Наиболее замечательной особенностью L-аскорбиновой кислоты является её способность образовывать окислительно-восстановительную систему, которая может как отдавать, так и принимать водородные атомы, точнее электроны и протоны. Наиболее быстро витамин С разрушается в присутствии окислителей в нейтральной или щелочной среде при нагревании. Поэтому при различных видах кулинарной обработки пищи часть витамина С обычно теряется, аскорбиновая кислота обычно разрушается также и при изготовлении овощных и фруктовых консервов. Особенно быстро витамин С разрушается в присутствии следов солей, тяжёлых металлов (железо, медь). В настоящее время, однако, разработаны способы приготовления консервированных фруктов и овощей с сохранением их полной витаминной активности.(5) 3. Титрование – метод количественного химического анализа. Это метод количественного химического анализа, который базируется на измерении точного объема раствора с точно известной концентрацией (титранта), истраченного на взаимодействие с определяемым веществом. Метод титриметрии заключается в том, что к раствору определяемого вещества постепенно добавляют раствор реактива, точно известной концентрации (титрант): Растворы реагента точно известной концентрации, который применяется для титрования в методах титриметрического анализа, называют стандартным раствором или титрантом. (6) Конечная точка титрования – момент титрования, когда наблюдается изменение расцветки раствора, который титруется, и в этот момент прекращают добавление титранта. Требования к реакции в титрометрии: 1) Вещества, которые вступают в реакцию, должны реагировать в строго определенных количественных соотношениях (количественно). 2) Реакция между определяемым веществом и стандартным раствором титранта должна проходить быстро и практически до конца. 3) Посторонние вещества, которые присутствуют в исследуемой пробе и перешли вместе с определяемым веществом в раствор, не должны мешать титрованию определяемого вещества (специфичность). 4) Конечная точка титрования должна фиксироваться тем или иным способом четко и точно. 5) Реакции должны проходить по мере возможности при комнатной температуре. Прямое титрование: Является более точным, так как в нем меньше источников для ошибок. Однако в некоторых случаях он оказывается неприменимым. Состоит в непосредственном титровании определяемого вещества рабочим раствором. В этом случае достаточно иметь только один рабочий раствор. (7) Обратное титрование: Применяют в тех случаях, когда реакция определяемого иона с рабочим раствором протекает до конца только при избытке в растворе реактива, содержащегося в рабочем растворе, и, таким образом, непосредственное титрование неприменимо. Кроме того, к методу обратного титрования прибегают, если определяемое вещество летуче и может потеряться в процессе титрования. Также в тех случаях, когда не требуется особая точность анализа, можно определение провести значительно быстрее и проще. Имеет большое практическое значение.(8) 4. Практическая часть. 4.1. Качественное определение витамина С. 1. Растворяют 0,1 г аскорбиновой кислоты в 2 мл воды и приливают 0,5 мл раствора нитрата серебра. Выпадает осадок металлического серебра. Этот метод установления подлинности предлагает использовать Международная фармакопея.(9) 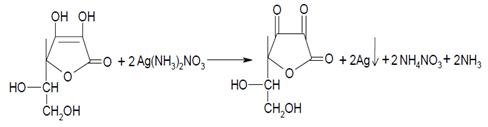 2. Принцип метода: восстановление феррицианида калия витамином С с изменением окраски до синей из-за образования берлинской лазури.(2) Ход работы. В двух пробирках смешивают 5 капель 5%-го раствора К3Fe(CN)6 c 5 каплями 1%-го раствора FeCl3. В одну из пробирок к зеленовато-бурой жидкости прибавляют 20 капель 1%-го раствора аскорбиновой кислоты, а в другую - столько же дистиллированной воды. Жидкость в первой пробирке приобретает зеленовато-синюю окраску, выпадает синий осадок берлинской лазури; во второй пробирке (контроль) зеленовато-бурая окраска жидкости остается без изменения.(10) Результаты качественных реакций представлены в Приложении 3. 4.2. Количественное определение витамина С. Йод легко окисляет аскорбиновую кислоту, при этом раствор йода быстро обесцвечивается. Данную реакцию можно применять для определения аскорбиновой кислоты в растворе методом титрования. В качестве индикатора используют крахмал. При добавлении избыточного количества йода в титруемый раствор, содержащий крахмал, раствор приобретает синюю окраску. При прямом титровании аскорбиновой кислоты раствором йода происходит следующая окислительно-восстановительная реакция: С6H8O6 + J2 → C6H6O6 + 2HJ Определение аскорбиновой кислоты методом прямого титрования. Анализ состоял из следующих этапов: - приготовление растворов титранта (раствора йода) и индикатора (раствора крахмала); - приготовление и измерение объёма исследуемого раствора; - титрование, запись результатов; - обработка экспериментальных данных; - обобщение результатов исследования. Анализировали три образца: образец 1 – зеленое яблоко, образец 2 – красное яблоко низшей ценовой категории, образец 3 – красное яблоко высшей ценовой категории. Приготовление раствора: Для приготовления раствора йода воспользовались аптечной 5%-ой настойкой йода. Расчёты для приготовления 0,005 М раствора йода из 5% -ного спиртового раствора йода: Соответственно для приготовления 100 мл раствора йода нужно 3,06 мл раствора йода. Титрование. Пипетку для титрования заполнили раствором йода. В коническую колбу для титрования добавили 20 мл исследуемого раствора и 0,5 мл раствора крахмала. Титровали раствором йода при энергичном перемешивании до появления синей окраски, не исчезающей в течение 20 секунд. Для каждого образца было проведено три измерения.(3) Расчеты результатов: Результаты прямого титрования представлены в Приложении 1. Наибольшее количество витамина С определено в образце 3 (2,85 мг на 100 мл сока), чуть меньше в образце 1 (2,2 мг на 100 мл), самый низкий показатель у образца 2 (1,75 мг на 100 мл). Определение аскорбиновой кислоты методом обратного титрования. В две колбы для титрования помещают соответственно 20 мл дистиллированной воды и 20 мл фруктового сока, подкисляют 4 мл серной кислоты и вводят пипеткой по 3 мл стандартного раствора йода. Через 3-5 минут обе пробы титруют раствором тиосульфата натрия. Крахмал добавляют в конце титрования, когда титруемый раствор приобретает бледно-желтую окраску, продолжают титровать до исчезновения синего окрашивания раствора. В принятых условиях другие восстановители(например, глюкоза) не реагируют с йодом.(1) Расчёты для обратного титрования: Результаты обратного титрования представлены в Приложении 2. Наибольшее количество витамина С определено в образце 1 (2,2 мг на 100 мл сока), чуть меньше в образце 2 (1,45 мг на 100 мл), самый низкий показатель у образца 3 (1,3 мг на 100 мл). Разницу в аналогичных образцах при прямом и обратном титровании можно объяснить тем, что для исследования брали разные яблоки в первом и во втором способе титрования. Заключение. По итогам проведенного исследования следует сделать следующие выводы и сформулировать практические рекомендации: 1. Концентрация растворов, приготовленных для титрования, является приблизительной, что обусловлено погрешностями при взятии навески, при измерении объёмов жидкостей. Следовательно, результаты титрования также являются приблизительными. Поэтому их достоверность можно поставить под сомнение. Однако, если использовать для титрования один и тот же раствор – тогда результаты разных определений можно будет сопоставить между собой. 2. Кроме того, при проведении титрования были сложности с определением точки конца титрования, это объясняется следующим: 2.1. на определение точки конца титрования с помощью индикатора влияют индивидуальные особенности человека и навык титрования; 2.2. естественный цвет сока маскировал изменение цвета индикатора. Для более удобного определения конца титрования пользовались сравнением окраски титруемого раствора с окраской свидетеля. Свидетелем служит дистиллированная вода (сок), в которую добавлен индикатор в таком же количестве, как в пробу. Вода (сок) налита в такую же точно колбу, как колба для титрования. 3. При проведении качественных реакций на витамин С ярко выраженный цветовой результат наблюдался только в чистом растворе витамина С. При проведении качественных реакций с соком изменение окраски было незначительным. С учётом вышесказанного, можно утверждать, что в адаптированном варианте методики качественного и количественного анализа витамина С могут быть использованы в условиях школьной лаборатории. Список литературы и интернет-ресурсов: 1. Воронаев И.Г. Химический анализ объектов окружающей среды- СПб., 2015г. 2. Прохорова Г.В. Качественный химический анализ. Практикум для школьников//М.:МГУ им. М.В. Ломоносова.-2006. 3. Фролова Н. К. Определение содержания витамина С в цитрусовых. Химия и химики.- №9, 2009 г. 4. https://health-diet.ru/article/nutrient_vitamins/vitamin_c_askorbinovaya_kislota/ 5. http://www.novostioede.ru/article/himiki_o_vitamine_s/ 6. https://infopedia.su/3x32fe.html 7. http://www.ngpedia.ru/id147841p1.html 8. http://www.ngpedia.ru/id147835p1.html 9. http://studbooks.net/2402128/matematika_himiya_fizika/ kachestvennye_reaktsii_askorbinovuyu_kislotu 10. http://cozyhomestead.ru/Vitaminy_52902.html |
