Лабораторная. Лабораторная работа №1. Отчет по лабораторной работе 1 алкилирование толуола пропиленом хтп18. 03. 0103. 01. 000 Лр исполнитель
 Скачать 131.32 Kb. Скачать 131.32 Kb.
|
|
Министерство науки и высшего Образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Уфимский государственный нефтяной технический университет» (ФГБОУ ВО УГНТУ) Филиал ФГБОУ ВО УГНТУ в г. Салавате Кафедра «Химико-технологических процессов» Общая химическая технология Отчет по лабораторной работе №1 АЛКИЛИРОВАНИЕ ТОЛУОЛА ПРОПИЛЕНОМ ХТП-18.03.01-03.01.000 ЛР Исполнитель: студент гр. БТП-19-21 В. А. Буланкин А. Д. Кизимов Д. А. Кувайцев А. Н. Ухов Руководитель: ст. преподаватель М. А. Маликова Салават 2022 Цель работы: изучить изменение состава алкилата в зависимости от продолжительности реакции, определение констант скоростей первой и второй стадий реакции, составление материального баланса опыта и определение конверсии пропилена, толуола, выхода целевого продукта, селективности процесса. Принадлежности и приборы: Толуол (90 г); AlCl3 (9 г), изопропиловый спирт (45 мл); дистиллированная вода, 10-% раствор щелочи NaOH. Схема процесса: 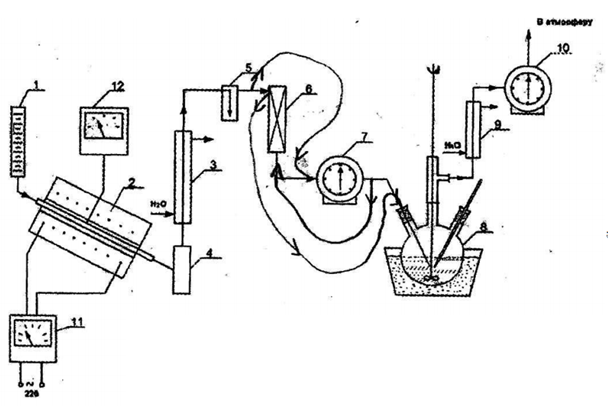 1-сырьевая бюретка; 2-реактор разложения изопропанола; 3,9-обратный холодильник; 4-приемник; 5-счетчик пузырьков; 6-осушитель с CaCl2; 7,10-газометр; 8-реактор алкилирования; 12-потенциометр Рисунок 1 – Схема лабораторной установки Теоретические сведения 1) Назначение процесса алкилирования, продукция, получаемые в результате процесса, их свойства и область использования. Реакции алкилирования имеют очень большое практическое значение для синтеза алкилароматических соединений, изопарафинов, меркаптанов, сульфидов, аминов, простых эфиров и т. д. Алкилирование ароматических соединений используют в промышленности для получения важных промежуточных продуктов нефтехимического синтеза, которые, в свою очередь, используются для получения мономеров, присадок к маслам, компонентов моторных топлив, поверхностно-активных веществ и т. д. 2) Алкилирующие агенты и катализаторы. В основе процесса алкилирования лежит реакция электрофильного замещения протона водорода на алкильную группу. Такую реакцию можно провести, используя различные алкилирующие агенты, которые можно разделить на три группы: а) Непредельные углеводороды. 6) Хлорпроизводные углеводородов, в) Спирты и эфиры. Олефины (этилен, пропилен и т. д.) имеют значение в качестве алкилирующих агентов. Ввиду относительной: дешевизны ими стараются пользоваться во всех случаях, где это возможно. Главное применение они нашли для С-алкилирования парафинов и ароматических. соединений. 3) Химизм и механизм процессов алкилирования. Алкилирование олефинами в большинстве случаев протекает по ионному механизму через промежуточное образование карбокатионов и катализируется протонными и апротонными кислотами. Реакционная способность олефинов в реакциях такого типа определяется их способностью образовывать карбокатион: RCH=CH2 + H+ = RC+H-CH3 Поэтому удлинение и разветвление цепи углеродных атомов в олефины значительно повышает его способность к алкилированию: CH2=CH2 В ряде случаев алкилирование олефинами может протекать по радикальному механизму. Здесь промежуточными активными частицами являются свободные радикалы, образованию которых способствует присутствие инициаторов радикально-цепных реакций: органические перекиси, динитрил азобисизомасляной кислоты, ультрафиолетовые лучи. Хлорпроизводные углеводородов являются алкилирующими агентами наиболее широкого диапазона действия. Они пригодны для алкилирования по атомам углерода, кислорода, серы, азота, а также для синтеза большинства элементо- и металлоорганических соединений. Применение хлорпроизводных рационально для тех процессов, в которых их невозможно заменить или когда использование Хлорпроизводных — дешевле, чем использование — олефинов. Алкилирующее действие хлорпроизводных проявляется в трех различных типах взаимодействия: электрофильном замещении нуклеофильном замещении и в свободно-радикальных процессах. Механизм электрофильного замещения характерен главным образом для алкилирования по атому углерода, но, в отличие от олефинов реакции катализируются только апротонными кислотами: Реакционная способность алкилхлоридов зависит от поляризации связи С-С! или от стабильности карбокатионов и повышается при удлинении и разветвлении алкильной группы: CH2H5Cl<(CH3)2CHCl<(CH3)3CCl Алкилирование спиртами и эфирами нашло менее широкое применение, Спирты могут использоваться для алкилирования по атомам кислорода и азота. Катализаторами в этом случае являются протонные кислоты. 4) Термодинамика и кинетика процессов алкилирования. Реакция алкилирования с активным комплексом хлористого алюминия идет очень быстро, сильно ускоряется при механическом перемешивании или интенсивном барботировании газообразных олефинов через реакционную массу и протекает в диффузионной или близкой к ней области. Скорость реакции повышается с ростом давления, но мало зависит от температуры, имея низкую энергию активации. Вероятно, лимитирующей стадией является стадия диффузии олефина через пограничную пленку каталитического комплекса хлористого алюминия, в которой протекает реакция. В отличие от этого переалкилирование идет значительно медленнее и существенно ускоряется при повышении температуры, так как имеет энергию активации Е = 63 кДж/моль. Обе реакции замедляются при постепенном дезактивировании катализатора, но особенно сильно падает скорость реакции переалкилирования. На дезактивирование катализатора влияет как наличие примесей в сырье, так и накопление некоторых побочных продуктов алкилирования, способных прочно связывать или образовывать стабильные комплексы, с трудом отдающие свой протон молекуле олефина. Такими веществами при низких температурах являются полиалкилароматические соединения, а при высоких температурах —полициклические ароматические соединения и смолы. В результате оказалось, что оптимальная температура, — обеспечивающая наибольшую производительность, лежит в пределах. 100°С. 5) Технологическое оформление процесса В промышленности алкилирование бензола олефинами проводят по непрерывной схеме. Алкилирование газообразными олефинами проводят в барботажных колоннах, внутренняя поверхность которых защищена от коррозии кислотостойкими плитками. Колонна заполнена жидкой реакционной массой, которая состоит из каталитического комплекса (20...40 % об.) и не растворимой в нем смеси ароматических соединений. В нижнюю часть колонны подают сухой бензол и олефин, который барботирует через жидкость, активно перемешивая ее. В верху колонны имеется боковой перелив для отвода продуктов. Тепло реакции отводится за счет нагревания реагентов и испарения бензола. Алкилат после реакции очищается от катализатора промывкой раствором щелочи и подвергается ректификации. Ход работы 1) Ознакомились со схемой лабораторной установки и методикой проведения лабораторной работы. Собрали установку, как показано на рисунке 1, и проверили надежность всех соединений. 2) В реактор алкилирования загрузили толуол (90г) и AlCl3 (9г), включили мешалку и подали воду в холодильники. Установили температуру в водяной бане 42…46 °С (по заданию преподавателя). 3) Загрузили изопропиловый спирт в сырьевую бюретку в количестве 45 мл. Включили электрообогрев реактора разложения спирта и постепенно поднимали температуру в нем до 290-300°С. Не допускали перегрева реактора, т. к. это может привести к быстрому закоксовыванию катализатора и потере его активности. 4) После вывода реакторов не заданный температурный режим медленно открыли кран капельной воронки и установили необходимый расход спирта. 5) Начали отсчет времени и через каждые 15 минут, в режимном листе записываем расход спирта, температуру в реакторах, расход газа в первом газометре. 6) Через каждые 30 минут после начала опыта из реактора пипеткой отбирали пробу 20-25 мл. К отобранной пробе для прекращения реакции добавляли 20 мл воды, а затем 20 мл 10%-ного раствора щелочи для отмывки от AlCl3. После отделения водного слоя, углеводородный слой отбирается для анализа на рефрактометр. 7) Через 90 минут после начала опыта, после отбора 3-х проб, прекращаем подачу спирта, выключаем электрообогрев реактора разложения спирта. Реакционную массу обрабатывают, как указано выше, и взвешивают. Обработка экспериментальных данных Таблица 1 – Режимный лист
Таблица 2 – Показатель преломления проб
Вывод: В ходе данной лабораторной работы, было изучено изменение состава алкилата в зависимости от продолжительности реакции. Производился отбор проб с разным временным промежутком. В ходе опыта было установлено, что с ростом времени проведения эксперимента, показатель преломления каждой из проб возрастал, следовательно, время, которое затрачивается на реакцию влияет на качество и процентный выход того или иного продукта. |
