ИСЛЕДОВАНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ. комплексные соединения. Отчет по лабораторной работе 3 иследование комплексных соединений
 Скачать 41.2 Kb. Скачать 41.2 Kb.
|
|
Министерство образования и науки Российской Федерации  Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования Санкт-Петербургский горный университет Кафедра общей и физической химииОТЧЕТПо лабораторной работе № 3«иследование комплексных соединений» Выполнил: студент гр. ___________ / / (подпись) (Ф.И.О.) Проверил: ___________ / / (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2022 Цель работы: познакомиться с методами получения комплексных соединений и их свойствами. Общие сведения: Комплексными называют соединения, в структуре которых можно выделить центральный атом – акцептор электронов, находящийся в донорно-акцепторной связи с определенным числом доноров-лигандов. Лигандами могут быть как ионы, так и нейтральные молекулы. Центральный атом и лиганды образуют внутреннюю сферу комплексного соединения, которую при записи формулы выделяют квадратными скобками. Внутренняя сфера часто имеет заряд, который компенсирует противоположно заряженные ионы, располагающиеся во внешней сфере. Внешнесферные ионы не имеют связей с центральным атомом, а образуют ионные связи с комплексными ионами. Поэтому в полярных растворителях (например, воде) комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:  ; ;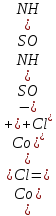 . .В первом случае в растворе практически отсутствуют цианид-ионы, поэтому соединение не относится к сильнодействующим ядам. Второе соединение будет реагировать с солями серебра (образование осадка AgCl), но не будет давать осадок 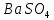 с растворами солей бария. с растворами солей бария. Первое соединение является анионным комплексом, поскольку содержит в своей структуре и образует при диссоциации в растворе комплексные анионы. Второе соединение является катионным комплексом. Существуют и нейтральные комплексы, у которых внутренняя сфера не имеет заряда и, соответственно, внешняя сфера отсутствует, например: 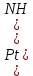 . .При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы (если таковые имеются), затем центральный атом, далее нейтральные лиганды, лиганы-анионы и в конце формулы записывают внешнесферные анионы. Читают формулу по принципу «справа налево». При этом название внутренней сферы произносят в одно слово, используя соединительную гласную «о», название комплексного аниона заканчивают суффиксом «-ат-». Молекулы воды в качестве лигандов обозначают приставкой «аква-», а молекулы аммиака – приставкой «аммин-». Степень окисления центрального атома при записи названия комплекса указывают римской цифрой в круглых скобках, заряды ионов – арабскими цифрами. Например, первое из приведенных выше комплексных соединений называется гексацианоферрат (II) калия, второе – хлорид сульфатотетраамминкобальта (III), третье – дихлородиамминплатина (II). Число связей, образуемых лигандом с центральным атомом, называют дентатностью лиганда. Например,  , ,  – монодентатные лиганды, а сульфат-ион – бидентатный лиганд. Число связей, образуемых центральным атомом с лигандами, называют координационным числом. Если лиганды монодентатные, координационное число равно числу лигандов в соединении, например, координационное число платины в – монодентатные лиганды, а сульфат-ион – бидентатный лиганд. Число связей, образуемых центральным атомом с лигандами, называют координационным числом. Если лиганды монодентатные, координационное число равно числу лигандов в соединении, например, координационное число платины в 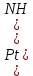 равно 4. Однако в равно 4. Однако в 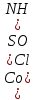 лигандов пять, а координационное число кобальта равно 6, поскольку сульфат-ион бидентантен. лигандов пять, а координационное число кобальта равно 6, поскольку сульфат-ион бидентантен. Порядок выполнения работы Опыт 1. Образование и разрушение амминокомлекса серебра. 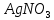 + NaCl → AgCl↓ + + NaCl → AgCl↓ + 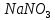 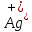 + +  + +  + + → AgCl↓ + → AgCl↓ +  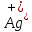 + +  → AgCl↓ → AgCl↓ (Наблюдаем выпадение белого осадка) AgCl +  * * 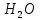 → →  +2 +2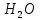 AgCl +  * * 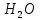 → → 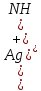 + +  + 2 + 2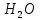 (Происходит растворение осадка)  + 2 + 2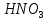 → AgCl↓ + 2 → AgCl↓ + 2 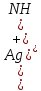 + +  + 2 + 2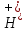 + +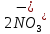 → AgCl↓ + → AgCl↓ + 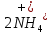 + + 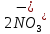 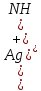 + +  + 2 + 2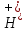 → AgCl↓ + → AgCl↓ + 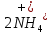 (Вновь происходит выпадение осадка белого цвета) Опыт 2. Образование и реакции амминокомлекса никеля.  + + 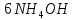 → →  ↓+ ↓+  + + 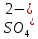 + +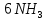 * * 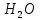 → →  ↓+ ↓+ (Наблюдаем образование голубовато-зелёного осадка)  + + * * 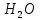 → →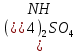 + +  + + * * 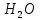 → →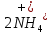 + + 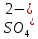 + + +2 +2 (Происходит растворение осадка и изменение окраски раствора на синеватый)  + + 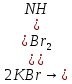 ↓+ ↓+  +2 +2 + 2 + 2 + +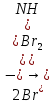 ↓+ 2 ↓+ 2 + +  + +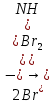 ↓ ↓(Происходит выпадение осадка фиолетового цвета) Опыт 4. Получение тетраиодовисмутата калия. 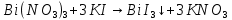   (Происходит выпадение осадка бурого цвета)    (Растворение осадка, раствор желтого цвета) Опыт 6. Образование гидрокомплекса цинка.  + +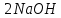 → →  + + 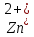 + + 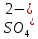 + 2 + 2 + + → →  +2 +2 + +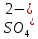 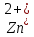 + + → →  (Наблюдаем выпадение осадка белого цвета)  + +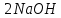 → →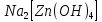  +2 +2 + + →2 →2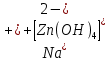  + + → →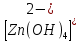 (Наблюдаем растворение осадка, раствор становится бесцветным) Ответы на вопросы: Какое свойство гидроксида цинка иллюстрирует данный опыт? - Амфотерность. Цинк - амфотерный металл, именно поэтому гидроксид цинка тоже проявляет амфотерные свойства (амфотерный гидроксид способен реагировать с щелочами, что и представлено в данном опыте). Опыт 7. Образование труднорастворимого гексацианоферрата(II). А)    (Образуется осадок темно-синего цвета (берлинская лазурь)) Б)   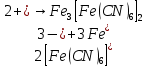 (Образуется осадок темно-синего цвета (турнбулева синь)) Вывод: В ходе лабораторной работы мы познакомились с методами получения комплексных соединений, изучили их свойства и рассмотрели их диссоциацию на ионы. |
